// Note : A cette séquence, doit être consacrée
1 heure, classe entière.
Il s'agit d'inventorier les activités du chimiste et les enjeux
de la chimie dans la société ; de dégager quelques
questions qui se posent au chimiste dans ses activités professionnelles.
L'objectif de cette introduction est de faire apparaître aux
élèves l'importance et la place des activités du chimiste
dans le monde contemporain au travers de leurs apprentissages antérieurs
et de la perception qu'ils ont de la chimie dans leur environnement quotidien
et dans l'industrie.
Il s'agit de faire prendre conscience des nombreuses questions auxquelles
le chimiste est confronté. Certaines font l'objet du programme de
la classe de terminale S, à savoir comprendre les processus d'évolution
des systèmes susceptibles de transformations chimiques, les contrôler,
maîtriser les protocoles opératoires et disposer d'outils
de mesure permettant de réaliser des contrôles de qualité
;.
Le travail du chimiste dans le monde contemporain peut être
classé par types d'activités dont certaines ont déjà
été vues par les élèves au laboratoire : extraire,
identifier, analyser, créer, purifier, protéger, recycler,
formuler, etc.
Il est envisagé dans cette introduction de dégager quelques
préoccupations du chimiste dans la société à
travers une réflexion sur le rendement, la durée de fabrication
et donc les coûts de production en chimie industrielle (chimie lourde
et chimie fine), les impacts sur l'environnement avec le recyclage et l'élimination
des matériaux.
L'enseignant sefforce d'organiser les réflexions et les réponses
des élèves en les regroupant et en les classifiant en vue
de faire émerger les quatre questions que le programme explore :
- La transformation d'un système chimique est-elle toujours
rapide ?
- La transformation d'un système chimique est-elle toujours
totale ?
- Le sens spontané d'évolution d'un système
est-il prévisible ? Et son corollaire, le sens d'évolution
d'un système chimique peut-il être inversé ?
- Comment le chimiste contrôle-t-il les transformations de la
matière ?
Après avoir donné des éléments de réponse
aux trois premières questions, la dernière partie permet
de montrer quelques exemples de stratégies mises en uvre par le
chimiste pour résoudre quelques uns des problèmes qu'il rencontre;
les exemples dans cette partie sont essentiellement pris en chimie organique.
A La transformation d'un système chimique est-elle toujours rapide ?
| Équation chimique |
|
|||||
| Quantité de matière à t = 0, en mol |
|
|||||
| Quantité de matière à la date t, en mol |
|
|||||
| Quantité de matière finale, en mol |
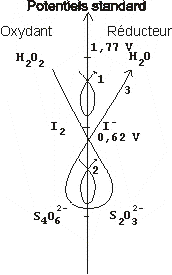
Un oxydant est une espèce chimique susceptible de
prendre un ou plusieurs électrons ; un réducteur une
espèce susceptible d'en donner.
Un couple d'oxydoréduction est constitué par un oxydant
et un réducteur conjugués. Ils sont reliés par une
demi-équation d'oxydoréduction (qui est une écriture
formelle).
Exemples : Oxydant + n é = Réducteur
Fe3+ + é = Fe2+
Une réaction d'oxydoréduction est un transfert d'électrons d'un réducteur (appartenant à un couple) vers un oxydant (appartenant lui aussi à un couple).
Avant l'équivalence, le réactif limitant est celui
ajouté à la burette ;
après l'équivalence, c'est le réactif introduit
initialement dans le bécher.
L'équivalence est atteinte lorsque les réactifs sont dans les proportions stchiométriques.
Au bureau : 1 L d'une solution d'ions thiosulfate de concentration
1 mol . L-1, 250 mL de solution d'iodure de potassium à
1 mol . L-1, 1 flacon d'empois d'amidon, réserve d'eau
distillée, 1,5 L d'acide sulfurique à 1 mol . L-1
et 100 mL d'eau oxygénée à 112 volumes (10 mol . L-1),
4 verres à pied, 1 pipette jaugée de 5 mL et 1 de 1 mL (à
défaut, une pipette graduée), 2 pipetteurs, 18 paires de
lunettes de sécurité. Bidon de récupération
des déchets liquides non organiques.
Pour chaque poste de 2 élèves : 1 burette graduée avec support, 1 agitateur magnétique, 1 erlenmeyer, 1 éprouvette graduée de 100 mL, 2 verres ou béchers (poubelles), 1 chronomètre.
Notes pour le professeur :
La vitesse de réaction est de la forme
v = K [I- ]m[H2O2]n
[H3O +]p.
Nous faisons en sorte que dans les conditions de l'expérience,
les 2 dernières concentrations soient constantes
| Retenez que la combinaison de plusieurs fonctions exponentielles n'est pas une exponentielle. |
Remarquez que ce travail pratique se prête assez mal à l'écriture d'un tableau d'avancement, car les ions iodure sont régénérés. Par contre, la diminution de la vitesse de réaction au cours du temps est flagrante.
La concentration de l'eau oxygénée pose problème, car par dismutation selon l'équation
H2O2 = H2O + 1/2 O2
elle diminue au cours du temps. Il faudrait, préalablement au TP, doser l'eau oxygénée avec des ions thiosulfate, afin de trouver l'asymptote à la courbe x = f (t) tracée par les élèves. Cette réaction est très lente et nécessite l'emploi d'un catalyseur, le molybdate d'ammonium. Elle devient alors assez rapide pour une concentration en eau oxygénée de 0,5 mol. L-1.
Nous pourrions lancer la réaction 1 à une date t = 0, fractionner le mélange réactionnel en échantillons de même volume, évoluant en parallèle, de manière identique. Puis doser la quantité de diiode formée, à des dates successives. Quelle précaution expérimentale faudrait-il prendre pour ces dosages ?
Une astuce expérimentale consiste à ajouter dès le départ une petite quantité d'ions thiosulfate. Ceux-ci réagissent rapidement avec le diiode formé (mais pas avec l'eau oxygénée), dont la coloration n'apparaît donc pas... jusqu'à ce qu'il n'y ait plus d'ions thiosulfate. A ce moment, consultez votre chronomètre et reversez la même petite quantité d'ions thiosulfate.
2.3.2. Manipulation :
Remplissez la burette graduée d'une solution d'ions thiosulfate
de concentration 1 mol . L-1. Comment procédez-vous ?
Versez dans un erlenmeyer 5 cm3 de solution d'iodure de potassium à 1 mol . L-1, un peu d'empois d'amidon, le tout complété à 50 cm3 , avec de l'eau distillée. Comment procédez-vous ?
Préparez dans l'éprouvette graduée un mélange de 50 cm3 d'acide sulfurique à 1 mol . L-1et de 1 cm3 d'eau oxygénée à 112 volumes (10 mol . L-1), ou 10 cm3 d'eau oxygénée à 1 mol . L-1. Quelles précautions devez-vous prendre ?
// Note : En divisant par 10 les concentrations de l'eau oxygénée (et donc du thiosulfate de sodium, mais pas forcément des autres réactifs), la vitesse de la réaction devient insuffisante et ne permet la mesure que de 5 à 6 points en une séance de travail pratique.
Placez l'erlenmeyer sur l'agitateur magnétique. Versez à l'aide de la burette 1 cm3 de solution d'ions thiosulfate à 1 mol . L-1.
A la date 0 (départ du chronomètre), versez l'éprouvette
graduée dans l'erlenmeyer. Chaque fois que la coloration due au
diiode apparaît, notez la date et reversez à la burette 1cm3
de solution d'ions thiosulfate. Si une quantité incorrecte est versée,
contentez-vous de la noter et poursuivez.
2.3.3. Équations :
Écrivez la demi-équation électronique correspondant au couple eau oxygénée, eau.
Écrivez la demi-équation électronique correspondant au couple diiode, ions iodure.
Écrivez la demi-équation électronique correspondant au couple ion tétrathionate, ion thiosulfate.
Écrivez l'équation correspondant à la réaction 1.
Écrivez l'équation correspondant à la réaction de dosage 2.
Établissez le tableau d'avancement de la réaction 1, aux dates t = 0, t ; pour l'avancement final, vous supposerez que la réaction est totale et que les ions iodure sont régénérés, donc ne peuvent être limitants. Quel est le réactif limitant pour la réaction 1 ?
A partir de l'équation de la réaction 2, trouvez la relation
entre la quantité y d'ions thiosulfate ajoutée et l'avancement
x de la réaction 1.
2.3.4. Exploitation des résultats :
Construisez un tableau comportant les dates, les quantités d'ions
thiosulfate versées et d'eau oxygénée consommée,
l'avancement x. Tracez la courbe d'avancement de la réaction en
fonction de la date.
Lorsque cette notion aura été définie en cours,
déterminez graphiquement la vitesse volumique de la réaction
à la date t = 0 et à la date t = 200 s. Comment la vitesse
volumique évolue-t-elle au cours du temps ? Vos résultats
sont-ils cohérents ?
Trouvez graphiquement le temps de demi-réaction t 1/2.
Résultats personnels et problèmes
| volume de thiosulfate versé, en mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| date t, en s | 0 | 33 | 67 | 109 | 156 | 214 | 286 | 386 | 534 | 841 |
// Note : Il semble que le Soleil provoque des dismutations
Les qualificatifs "lent" et "rapide" n'ont pas de valeur dans l'absolu.
Ils dépendent des souhaits de l'expérimentateur et de l'instrumentation
qu'il utilise. Il est nécessaire que le temps de réponse
de l'instrument d'analyse soit petit par rapport au temps de relaxation
du système vers son état final.
Exemple de réaction rapide : Décomposition explosive du
nitrate d'ammonium.
Exemple de réaction lente : Estérification.
Nous définirons la vitesse de réaction dans la leçon suivante.
La vitesse de réaction augmente en général
avec la concentration des réactifs.
Expérience de cours : Rétroprojecteur
; HCl à 1 mol . L-1, Na2S2O3
(thiosulfate de sodium) à 0,2 mol . L-1, ou même moins car
le précipité est trop opaque. Préparez 3 béchers
contenant 10 mL de Na 2S2O3 et 40, puis
20, puis 10 mL de HCl, complétés à 50 mL avec de l'eau
distillée. Le réactif limitant est Na2S2O3
; nous mettons en évidence le rôle de la concentration de
HCl.
S2O32- + 2 H3O+=
SO 2 + 3 H2O + S
La vitesse de réaction augmente en général
avec la température.
On admet qu'une élévation de température de 10°C double la vitesse d'une réaction.
Expérience de cours : Solution d'ions iodure à1 mol . L-1, et d'ions peroxodisulfate à 1 mol . L-1 .Répartir 2,5 mL de chaque dans 3 x 2 tubes à essai, 2 dans la glace, 2 à température ambiante, 2 dans de l'eau chaude.
Applications : Trempe chimique, conservation des aliments, cuisson des aliments à la cocotte minute, contrôle des processus chimiques industriels.
2.5.3. Autres facteurs cinétiques : État de division pour les réactifs solides, éclairement, nature du solvant, catalyseur...
Pages 39 et suivantes, exercices n° : 17, 18, 19, 22, 23 (Type
bac).
L'exercice 22 comporte une erreur dans son énoncé (la
courbe correspondant à l'expérience 3 coupe son asymptote)
et son corrigé (ils n'ont pas pris en compte le doublement de volume
lié au mélange des 2 réactifs).
La vitesse volumique v, à une date t, d'une réaction
se déroulant dans un volume V (constant), est numériquement
égale au quotient de la dérivée par rapport au temps
de l'avancement x de la réaction, par ce volume V.
| v(t) = 1 / V . (dx / dt) |
Le terme dx / dt est donné par le coefficient directeur de
la tangente à la courbe x (t), au point considéré.
Attention : Tracez bien une tangente et pas une
sécante. Contrairement aux mathématiques, tenez
compte des unités sur chaque axe, mol et s.
// Remarque personnelle à l'attention des
professeurs, des correcteurs d'épreuves du baccalauréat et
des futurs enseignants de physique :
J'ai constaté que, en dehors des erreurs classiques
sur les calculs de quantités de matière et de concentrations,
en dehors des erreurs d'unités lors des calculs de vitesses, les
élèves ont du mal à tracer avec une précision
suffisante les tangentes, le plus difficile pour eux, étant le tracé
à la date zéro. Certains pensent que à cet instant
la vitesse est nulle, car la réaction n'a pas commencé, d'autres,
plus mathématiciens, sont gênés par le fait que la
fonction n'est pas dérivable au point t = 0. (En fait, si on effectue
un enregistrement de l'activité, en continu, en commençant
avant le mélange des deux réactifs, il s'avère que
la courbe physiquement obtenue, est bien à dérivée
continue - Ce qui veut dire qu'il est impossible de mélanger instantanément
les deux réactifs. La discontinuité, bien pratique sur le
plan pédagogique, est introduite par notre méthode de mesure
discontinue.)
Mais la dernière difficulté est d'ordre
pratique : Lorsque les élèves doivent tracer la tangente,
au point t= 0, ils ont tendance à donner une pente trop forte à
leur tracé. La raison est qu'il ne peuvent pas utiliser en ce point
une (quasi) symétrie locale de la courbe, celle-ci présentant
une pente discontinue.
Voici les résultats d'un sondage effectué
sur un groupe de 26 élèves, traçant les tangentes
à une courbe faussement expérimentale, calculée à
partir d'une fonction exponentielle : A une date 600 s, le résultat
calculé est de 0,0841 mmol . L-1 . min-1. Ils trouvent
graphiquement, en moyenne 0,0838 mmol . L-1 . min-1, avec un
écart-type de 0,0146 mmol . L-1 . min-1. Soit une erreur
de 17 %, mais bien centrée autour de la bonne valeur.
A la date 0, ils trouvent en moyenne 0,748 mmol . L-1
. min-1, avec un écart-type de 13 %, alors que le résultat
calculé est de 0,703 mmol . L-1 . min-1. Leurs
résultats sont plus homogènes, mais systématiquement
trop grands.
Il serait bon que cette difficulté soit prise
en compte dans les barèmes du baccalauréat.
On appelle temps de demi-réaction t 1/2, la durée
nécessaire pour que l'avancement parvienne à la moitié
de sa valeur finale.
C'est aussi la durée nécessaire pour que
la moitié du réactif limitant disparaisse.
// Notez l'analogie avec le temps de demi-vie des isotopes
radioactifs.
La valeur de t 1/2 nous permet de choisir la méthode la mieux adaptée au suivi de la cinétique.
Un spectrophotomètre comporte une source de lumière
blanche, émettant un flux lumineux parallèle F0,
suivie d'un système permettant de ne laisser passer qu'une seule
longueur d'onde. Le faisceau lumineux traverse ensuite une cuve remplie
du liquide à étudier. A la sortie un détecteur reçoit
un flux
F, correspondant à une certaine
tension de sortie.
Commençons par des exemples numériques : Supposons que
le filtre absorbe 90 % de la lumière. Il en laisse donc passer 10
%, c'est à dire un flux F1 =
0,1 F0.
Si la cuve, pleine d'un liquide parfaitement transparent, absorbe 30
% de la lumière, F2 = 0,7
F1
=
0,7 x 0,1 F0.
Si le solvant remplissant la cuve absorbe 10 % de la lumière,
F3
=
0,9 x 0,7 x 0,1 F0.
Ce résultat, dépend du filtre et du solvant employés
; cela justifie qu'avant toute mesure, nous devions effectuer le réglage
du zéro d'absorbance du colorimètre (appelé aussi
réglage du blanc, qui devrait plutôt s'appeler réglage
du transparent, puisque la lumière employée est colorée
par le filtre), pour ne tenir compte que de la perte de lumière
due à l'absorption par les espèces chimiques qui nous intéressent.
Nous réglons la tension de sortie du détecteur, à
la valeur correspondant à 100 %, soit une transparence parfaite.
Supposons maintenant que nous versions dans la cuve, supposée
donc ne plus absorber la lumière, une solution absorbante de concentration
c. Supposons qu'elle absorbe 90% de la lumière ; il n'en passera
que 10 %, soit 0,1 F100%.
Imaginons que nous ajoutions une deuxième cuve identique, derrière
la première ; il passera 0,1 x 0,1 F
100%.
| Absorbance | pourcentage transmis | écrit en puissance de 10 |
| 0 | 100 % | 1 = 100 |
| 1 | 10 % | 0,1 = 10-1 |
| 2 | 1 % | 0,1 x 0,1 = 10-2 |
|
L'absorbance due à une espèce est proportionnelle à la concentration de cette espèce, pour une épaisseur donnée de solution. |
Nous allons suivre la réaction du peroxodisulfate
d'ammonium sur l'iodure de potassium ; elle produit du diiode I2,
qui se lie à un ion I-, pour donner un ion coloré,
I3- . Le peroxodisulfate d'ammonium sera le réactif
limitant, de telle manière que la concentration d'iodure de potassium
variera très peu au cours de la transformation, et qu'il restera
toujours suffisamment d'ions iodure pour donner les ions colorés
I3-.
Notons, de plus, qu'à la longueur d'onde choisie, 600 nm(ou 575
nm), l'iodure de potassium et le peroxodisulfate d'ammonium sont beaucoup
plus transparents qu'une solution d'ion coloré I3-.
Pour chaque groupe : 1 colorimètre à
filtre (spectrophotomètre simplifié, dont le monochromateur
est remplacé par un filtre), 1 filtre de couleur bleue (440 nm),
2 cuves à colorimétrie, 1 chronomètre, 1 petit bécher,
1 baguette de verre pour agiter, 1 pissette d'eau distillée, 1 éprouvette
graduée de 100 mL.
Au bureau : 4 verres à pied, 4 pipettes
jaugées de 10 mL, 4 propipettes, 250 mL de solution d'iodure de
potassium de concentration 0,5 mol . L-1, 250 mL de solution
de peroxodisulfate d'ammonium de concentration 0,1 mol . L-1,
250 mL de solution de diiode (contenant aussi des ions iodure) de concentration
0,01 mol . L-1, réserve d'eau distillée. Bidon de récupération
des déchets liquides non organiques.
// Note : Préparation de la solution de
diiode : Les ions iodure sont indispensables à la mise en solution
du diiode solide; préparez la solution longtemps à l'avance,
la dissolution se fera d'elle même.
Nous allons suivre la réaction de l'eau oxygénée
sur l'iodure de potassium, en présence d'acide ; elle produit du
diiode I2 , qui se lie à un ion I-, pour donner
un ion coloré, I3 -. L'eau oxygénée
sera le réactif limitant, de telle manière que les concentrations
d'acide sulfurique et d'iodure de potassium varieront très peu au
cours de la transformation, et qu'il restera toujours suffisamment d'ions
iodure pour donner les ions colorés
I3 -.Notons,
de plus, qu'à la longueur d'onde choisie, 440 nm, l'iodure de potassium
et le peroxodisulfate d'ammonium sont beaucoup plus transparents qu'une
solution d'ion coloré I3 -. L'eau oxygénée
se dismutant, nous emploierons une solution préparée avec
de l'eau oxygénée achetée récemment. Car nous
ne possédons pas le catalyseur (molybdate d'ammonium) qui permettrait
son
dosage par les ions thiosulfate (voir
leçon précédente).
Pour chaque groupe : 1 colorimètre à filtre
(spectrophotomètre simplifié, dont le monochromateur est
remplacé par un filtre), 1 filtre de couleur bleue (440 nm), 2 cuves
à colorimétrie, 1 chronomètre, 1 petit bécher,
1 baguette de verre pour agiter, 1 pissette d'eau distillée, 1 éprouvette
graduée de
25, 50 ou 100 mL.
Au bureau : 5 verres à pied, pipettes jaugées de 10 mL, 3 de 5 mL, 2 de 1 mL, 3 propipettes en état, 500 mL de solution d'iodure de potassium de concentration 0,1 mol . L-1 (à défaut 1 mol . L-1), 250 mL de solution d'eau oxygénée de concentration 0,1 mol . L-1(1,1 volume), 250 mL d'acide sulfurique de concentration 1 mol . L-1, 250 mL de solutions de diiode (contenant aussi des ions iodure) de concentrations 5 . 10-3mol . L-1 , 2 . 10-3 mol . L-1, 1 . 10-3mol . L -1, réserve d'eau distillée. Bidon de récupération des déchets liquides non organiques.
// Note : Préparation de la solution de diiode : Les ions iodure sont indispensables à la mise en solution du diiode solide; préparez la solution longtemps à l'avance, la dissolution se fera d'elle même. Dans 1 litre d'eau, vous pouvez ajouter 1,27g de diiode et 5 g d'iodure de potassium, pour obtenir une solution de concentration de 0,01 mol . L-1. Elle sera ensuite diluée 2, 5 ou 10 fois. Certains colorimètres saturent à une absorbance de 2, pour une concentration en ions triiodure de 0,01 mol . L-1.
Tracez dans Excel la courbe d'absorbance en fonction de la concentration.
Ajustez cette courbe par un segment de droite dont vous relèverez
l'équation.
Il est possible de forcer Excel à chercher une équation
du type y = a x, au lieu de y = a x + b.
Tracez la courbe d'avancement en fonction de la date, x = f (t).
Excel n'est pas capable d'ajuster cette courbe par une fonction exponentielle.
Pour y parvenir, tracez la fonction Xfinal - avancement x, où Xfinal
est l'avancement final (l'ordonnée de l'asymptote à la courbe
précédente x = f (t)). Choisissez d'abord un Xfinal un peu
trop grand.
Déclarez Xfinal comme une constante pour Excel.
Puis faites-le varier de manière à maximiser le coefficient
de régression R2 (qui doit être proche de 1).
Sur la première courbe x = f (t), portez l'asymptote que vous venez de trouver. Correspond-elle à l'avancement x maximal attendu pour la transformation ? Quel est le pourcentage d'erreur relative ?
Lors des calculs précédents, nous avons supposé
la transformation totale. Il serait souhaitable de le vérifier.
Pour cela, mesurez l'absorbance d'une solution d'ion coloré, I3-,
de concentration 0,01 mol . L-1, après réglage
du zéro sur de l'eau distillée.
Proposez un protocole destiné à vérifier, le plus
simplement possible la loi de Beer-Lambert de relation linéaire
entre absorbance et concentration.
// Note : Il suffit pour nous de vérifier que le point situé "au milieu" des 2 autres est bien aligné avec eux. Donc de diluer 2 fois la solution d'origine. Il pourrait être utile de tracer la courbe pour des concentrations plus faibles, 1/10 et 1/100° de la concentration initiale.
Pages 57 et suivantes, exercices n° : 10, 12, 14 (Exercice mal
construit ; il aurait été préférable de donner
une courbe d'avancement en fonction de la date, plutôt que de concentration.
1 erreur dans le corrigé, qui ne tient pas compte du cfficient
stchiométrique 2 dans l'équation donnée => coefficient
1/2 dans le résultat).
Pages 76 et suivantes, exercices n° : 13, 14.
Dans une solution, les particules devant réagir sont éloignées
les unes des autres par les molécules de solvant. Du fait de la
température, elles sont animées de mouvements d'agitation,
provoquant des mouvements incessants, au cours desquels, il leur arrive
de se rapprocher.
Lorsque deux particules de réactifs s'approchent (pour simplifier,
nous appellerons cela un choc), elles peuvent réagir ou pas. (Environ
1 réaction, donc 1 choc efficace, sur 10 milliards de chocs).
Il y a un seuil énergétique à franchir. Or l'énergie
cinétique des particules en mouvement augmente avec la température.
Lorsque la température augmente, la vitesse et l'énergie cinétique des particules augmentent. Cela accroît donc le nombre de chocs et de plus augmente le pourcentage de chocs efficaces.
Une question tracasse certains élèves : Pourquoi tenir
compte du volume ? Quel volume prendre en compte ?
En effet, lors du travail pratique précédent, nous avons
préparé 40 mL de mélange réactionnel dans le
bécher, puis nous en avons prélevé quelques mL, pour
le colorimètre. Faut-il considérer les 40 mL, les 2 ou 3
mL, 38 ou 37 mL restant dans le bécher ?
Je vous propose l'argumentation suivante : Imaginez que vous ayez rempli
la cuve à colorimétrie, après avoir bien agité
le milieu réactionnel, mais que vous l'ayez posée dans le
bécher. Bien sur, vous ne pourrez plus faire de mesures ; mais la
transformation chimique est-elle la même dans le bécher et
dans la cuve ? Oui, car les dimensions de la cuve sont énormes,
pour les phénomènes microscopiques qui se produisent.
L'avancement est-il le même dans les 2 récipients ? Non,
car il s'exprime en quantité de matière. L'avancement est
proportionnel aux quantités initiales mises dans chaque récipient.
L'avancement dans chaque récipient, divisé par le volume
de chacun est-il le même ? Oui.
Donc, le plus simple est de considérer le volume de 40 mL, et l'avancement dans ce volume, comme s'il n'y avait pas eu de prélèvement(s).
Le programme officiel a donc bien fait de se concentrer sur la vitesse volumique, qui ne dépend pas de la technique de mesure employée, pas de prélèvement (TP de la leçon 2), 1 prélèvement (TP de la leçon 3), plusieurs prélèvements (autres TP possibles).
Pas d'exercices.
B La transformation d'un système
chimique est-elle toujours totale ? 3 leçons suivantes, correspondant
à 4 TP, 9 H classe entière
Cette série de 3 leçons comporte des
graphiques.
Sur ce site, ils sont au format .gif et ne donnent donc pas une très
bonne qualité à l'impression. Certains (domaine de prédominance,
titrages d'un acide par une base, avec méthode des tangentes et
dérivée, titrage d'une base par un acide, avec dérivée,
titrage d'un acide à différentes concentrations) ont été
placés dans un document Word 95, au format
Emf qui permet une meilleure qualité
à l'impression.
L'acide éthanoïque CH3COOH est susceptible
de céder un proton H+ ; c'est un acide au sens de Brfnsted.
L'ion éthanoate CH3COO- est susceptible
de capter un proton H+ ; c'est une base au sens de Brfnsted.
Ces 2 espèces chimiques sont dites conjuguées et constituent
un couple acide / base, relié par la demi-équation acido-basique
:
CH3COOH = CH3COO- + H+.
L'eau se comporte à la fois comme un acide, dans le couple
eau
H2O / ion hydroxyde HO-, et comme une base dans
le couple ion oxonium (ou hydronium) H3O+
/
eau
H2O. C'est un ampholyte, ou espèce amphotère.
Considérons la mise en solution dans l'eau pure de l'acide
éthanoïque pur. Ce dernier est un liquide (dangereux, attention
à ne pas respirer ses vapeurs) isolant, donc ne contenant pas d'ions.
CH3COOH + H2O = CH3COO-
+ H3O+.
Vous constatez un transfert de proton de l'acide éthanoïque,
forme acide du couple acide éthanoïque / ion éthanoate,
CH3COOH / CH3COO-, vers la base (eau)
du couple ion oxonium / eau, H3O+ / H2O.
Considérons un autre exemple : Une solution d'acide chlorhydrique,
ajoutée à une solution d'ions benzoate (base), provoque la
précipitation d'acide benzoïque, insoluble dans l'eau.
C6H5COO- + H3O+
= C6H5COOH + H2O.
Le pH d'une solution est défini par la relation :
| pH = - log [H3O+] |
Cette relation peut aussi s'écrire : [H3O+] = 10-pH.
Notez que la fonction logarithme est une fonction croissante, donc que le pH diminue, lorsque la concentration en ions oxonium augmente (à cause du signe moins). D'autre part, retenez que log(10) = 1, log(100) = 2... Il s'agit bien d'un logarithme décimal.
Un pH-mètre est constituée par une sonde (formée
par 2 électrodes) délivrant une tension électrique
U qui est fonction affine du pH, et par un voltmètre à très
forte impédance d'entrée (pour que la sonde ne débite
pas de courant électrique). Les coefficients a et b de la relation
U = a + b . pH, dépendent de la température. Le pH-mètre
doit donc être étalonné avant usage, au lycée,
à l'aide de 2 solutions tampons, d'abord à pH = 7, puis à
pH = 4.
// Les professeurs noteront que certaines sondes (les moins chères) ne sont pas capables de mesurer correctement les pH supérieurs à 10. Il est conseillé d'acheter des sondes données pour pH 0 à 14.
Notez que les concentrations calculées à partir d'une mesure de pH sont imprécises.
Considérons la réaction de mise en solution dans l'eau
de l'acide éthanoïque pur, décrite par l'équation
:
CH3COOH + H2O = CH3COO-
+ H3O+.
Le réactif limitant est l'acide éthanoïque. Pour
une concentration apportée (appelée parfois initiale, celle
qui est marquée sur le flacon) de celui-ci de 0,01 mol . L-1,
l'avancement maximal (si la réaction était totale) pourrait
être de 0,01 mol (pour 1 litre de solution). La concentration en
ions oxonium serait alors de 0,01 mol . L-1, et le pH serait
mesuré égal à 2. Or le travail pratique suivant montre
qu'il n'en est rien. Le pH est supérieur à 2, ce qui signifie
que l'avancement final, xfinal est inférieur à
l'avancement maximal, xmaximal, 0,01 mol.
Dans son état final, le système contient donc de l'eau (en grand excès), de l'acide éthanoïque, des ions éthanoate et des ions oxonium.
| Cette transformation chimique n'est pas totale, le système
chimique est dans un état d'équilibre.
Aucun des réactifs n'a disparu, l'avancement final est inférieur à l'avancement maximal. |
Par définition,
Le taux t d'avancement final d'une réaction
est le rapport de l'avancement final xfinal, et de l'avancement
maximum xmaximal (obtenu si la réaction est totale).
| t = xfinal / xmaximal |
Vous devez savoir le calculer, à partir d'une mesure.
Par exemple, en travail pratique, nous avons mesuré un pH de
3,4 pour une solution d'acide éthanoïque de concentration apportée,
de 10-2 mol . L-1. Cela signifie une concentration
en ions oxonium de 10-3,4 = 4,0 . 10-4 mol
. L-1. Soit, en appelant v le volume de solution considéré,
un avancement final : xfinal = 4,0 . 10-4 . v.
L'avancement maximal pourrait être : xmaximal = 1,0
. 10-2 . v. Soit un taux d'avancement final :
t = xfinal / xmaximal
ou t = 4,0 . 10-4 / 1,0
. 10-2 = 0,04.
Exercice : Calculez, avec ce même exemple, les concentrations
finales des diverses espèces chimiques, et les quantités
contenues dans 50 mL de solution.
Notez que nous avons supposé que les ions oxonium proviennent
tous de la réaction envisagée, CH3COOH + H2O
= CH3COO- + H3O+. Nous verrons
qu'il s'agit d'une excellente approximation.
Considérons la mise en solution dans l'eau de l'acide éthanoïque,
d'équation : CH3COOH + H2O = CH3COO-
+ H3O+.
Si nous ajoutons 1 goutte d'acide éthanoïque, le pH diminue,
le système évolue dans le sens direct de l'équation
; si nous ajoutons un peu d'éthanoate de sodium, le pH augmente,
le système évolue dans le sens inverse de l'équation.
Nous avons ajouté de faibles volumes, pour ne pas trop modifier
celui de la solution.
Le fait qu'une transformation peut s'effectuer dans les 2 sens sera
examiné plus en détail, lors d'une prochaine leçon.
Dans l'état final, les quantités de réactifs
et de produits restent constantes ; nous dirons que le système est
en équilibre. Cet équilibre est dynamique : Il y a autant
de chocs efficaces entre réactifs, donnant des produits, qu'entre
produits, donnant des réactifs.
Nous nous proposons de mesurer les pH de solutions dans l'eau, d'acide
éthanoïque, d'acide méthanoïque et d'acide chlorhydrique,
à différentes concentrations.
5.6.0. Matériel nécessaire
Voici une liste minimale :
Au bureau : Solutions d'acides chlorhydrique, éthanoïque
et méthanoïque, de concentrations égales, par exemple
1 ou 5 . 10-2 mol . L-1 ; 3 verres à pied
; 3 pipettes jaugées de 10 mL et 3 pipetteurs. Flacons ou bouteilles
d'acides chlorhydrique, éthanoïque et méthanoïque,
concentrés ou purs. Flacon d'éthanoate de sodium, spatule.
Solutions tampons de pH 7 et 4 et 2 verres à pied, plus 2 grands
béchers servant de poubelle. Réserve d'eau distillée,
essuie-tout, morceaux de papier filtre. Bidon de récupération
des déchets liquides non organiques.
Pour chaque groupe : pH-mètre, fiole jaugée de 100 mL, 2 ou 3 béchers ou verres ordinaires, pissette d'eau distillée.
5.6.1. Étalonnez le pH-mètre. Comment procédez-vous
?
// Note : Une variante peut être apportée aux questions
suivantes, en partant d'une concentration de 5 . 10-2 mol .
L-1, et en diluant 10 fois, 2 fois de suite. Rappelons au professeur,
ou futur professeur, que le pH d'une solution d'acide chlorhydrique de
concentration 1 . 10-1 mol . L-1, est de 1,1 au lieu
du 1 donné par la définition du cours. Il est possible que
chaque groupe de 2 élèves n'effectue qu'une partie des dilutions
ou mesures, et que les résultats finaux soient mis en commun.
5.6.2. A partir d'une solution d'acide chlorhydrique de concentration
apportée, de 0,01 mol . L-1, préparez des solutions
de concentrations 10-3 et 10-4 mol . L-1.
Comment procédez-vous ? Notez votre méthode sur votre compte
rendu. Mesurez leur pH.
5.6.3. A partir d'une solution d'acide éthanoïque
(appelé aussi acide acétique) de concentration apportée,
de 10-2 mol . L-1, préparez des solutions
de concentrations 10-3 et 10-4 mol . L-1.
Comment procéderiez-vous pour préparer la solution initiale
à 10-2 mol . L-1, à partir d'eau et
d'acide purs ? Notez votre méthode sur votre compte rendu, y compris
les mesures de sécurité à respecter. Mesurez les 3
pH. Attention, l'acide éthanoïque pur est dangereux.
Remarque : L'étiquette de la bouteille d'acide éthanoïque porte les indications suivantes :
| Acide acétique 99 - 100 %
Pur C2H4O2 M = 60,05 g / mol % 99,5 d = 1,05 ou, pour un autre flacon 100 % Normapur |
| Acide formique 98 %
CH2O2 M = 46,03 g / mol d = 1,22 |
Voici, à titre d'information, les courbes tabulées obtenues pour l'acide éthanoïque (en noir) et l'acide chlorhydrique (en magenta). Pour des pH inférieurs à 6, le taux d'avancement est égal à 1 pour l'acide chlorhydrique. Cela conduit à pH = - log(Concentration apportée), donc à une représentation graphique par un segment de droite de pente égale à 1.
Pour des pH inférieurs à 6, le taux d'avancement est inférieur à 1 pour l'acide éthanoïque (et se rapproche de 1 pour pH = 6). Le pH mesuré est supérieur à - log(Concentration apportée).
Vers pH 7, les ions oxonium proviennent essentiellement de l'eau et les approximations faites, assimilant les concentrations en forme basique et en ion oxonium, ne sont plus valables.
 |
| Figure 2 |
| Concentration apportée, en mol . L-1 | 5 . 10-2 | 10-2 | 5 . 10-3 | 10-3 | 5 . 10-3 | 10-4 |
| HCl et eau, pH mesuré | 1,95 | 2,96 | 4,00 | |||
| HCl et eau, pH tabulé | 1,3 | 2,0 | 2,3 | 3,0 | 3,3 | 4,0 |
| Taux d'avancement final | ||||||
| CH3COOH et eau, pH mesuré | 3,40 | 3,82 | 4,42 | |||
| CH3COOH et eau, pH tabulé | 3,03 | 3,36 | 3,51 | 3,88 | 4,04 | 4,45 |
| Taux d'avancement final | ||||||
| CHOOH et eau, pH mesuré | ||||||
| CHOOH et eau, pH tabulé | 2,54 | 2,9 | 3,07 | 3,46 | 3,65 | 4,15 |
| Taux d'avancement final |
Pages 114 et suivantes, exercices : 6.1, 6.2, 7.1, 7.2, 7.3, 8.2,
8.3, 12, 15, 19
Un conducteur ohmique suit la loi d'Ohm, U = R . I, qui exprime
que la tension U (en volt) entre ses bornes est proportionnelle à
l'intensité I (en ampère) qui le traverse. R est la résistance
du conducteur ohmique, mesurée en ohm W.
Cette loi peut aussi s'écrire I = G . U, où G est la conductance du conducteur ohmique, exprimée en siemens S. Les grandeurs G et R sont inverses, G = R-1 et réciproquement.
La conductance d'une solution ionique placée entre deux électrodes
de surface S (en m2), distantes de L (en m), est proportionnelle
à S (plus les électrodes sont importantes, mieux le montage
conduit), inversement proportionnelle à L (plus les électrodes
sont éloignées, moins le montage conduit, ou plus il résiste).
G = s . S / L.
s est la conductivité de la solution
(plus la conductivité de la solution est élevée, plus
le montage conduit, donc a une grande conductance) exprimée en siemens
par mètre (S . m-1).
Les ions positifs (qui se déplacent du + vers le -) et les ions
négatifs (qui se déplacent en sens inverse) contribuent tous
à la conductivité, proportionnellement à leur concentration.
s = Si
lXi
. [Xi],
où lXi est
la conductivité molaire ionique de l'ion Xi qui se mesure
en siemens . mètre carré par mole (S . m2 . mol-1).
| Attention : En conductimétrie, les concentrations doivent se mesurer en mole par mètre cube. |
Considérons la réaction : CH3COOH + H2O
= CH3COO- + H3O+. Par définition,
le quotient de réaction qui lui est associé est :
Qr = [CH3COO-] . [H3O+]
/ [CH3COOH].
Où les concentrations, sont mesurées dans un état
du système (état initial, ou final ou...), en mole par
litre, les unités n'étant pas conservées. Seules
les espèces chimiques solubles sont prises en compte ; l'eau n'est
pas prise en compte.
Pour une réaction en solution aqueuse d'équation a
A + b B = c C + d D, le quotient de réaction, est :
| Qr = [C]c . [D]d / ([A]a . [B]b) |
// Notez que l'addition dans l'équation correspond à une multiplication dans le quotient de réaction, et que la multiplication dans l'équation correspond à une puissance dans le quotient de réaction.
// Notez que si vous inversez les deux membres de l'équation, le nouveau quotient de réaction est l'inverse du précédent.
| Concentration apportée, en mol . L-1 | 10-2 | 10-3 | 10-4 |
| CH3COOH et eau, pH mesuré | 3,4 | 3,8 | 4,42 |
| CH3COOH et eau, pH tabulé | 3,41 | 3,93 | 4,49 |
| Quotient de réaction initial, Qr, t=0 | |||
| [H3O+] à l'équilibre, en mol . L-1 | |||
| Quotient de réaction à l'équilibre, Qr, équ | |||
| Taux d'avancement final |
Déduisez des conductivités, les concentrations des espèces
ioniques en solution.
On donne lCH3CO2-
= 4,09 . 10-3 S . m2 . mol-1 , lCHO2-
= 5,46 . 10-3 S . m2 . mol-1 et lH3O+
= 35,0 . 10-3 S . m2 . mol-1.
Solution d'acide éthanoïque,e CH3COOH :
| Concentration apportée, en mol . L-1 | 5.10-2 | 10-2 | 5.10-3 | 10-3 | 5.10-4 | 10-4 |
| Conductance mesurée, en S | 370.10-6 | |||||
| Conductivité calculée en S . m-1. | 0,0389 | |||||
| [H3O+] calculée, en mol . L-1 | ||||||
| Quotient de réaction à l'équilibre, Qr, équ | ||||||
| Taux d'avancement final | ||||||
| A titre d'information,
conductivité tabulée en S . m-1. |
0,038626 | 0,017062 | 0,011954 | 0,0051414 | 0,0035311 | 0,0013981 |
Il faut absolument éviter 2 erreurs : Celle concernant
la définition et les conversions d'unités pour la constante
de cellule ; celle concernant les unités employées pour mesurer
les concentrations.
Nous constatons que le taux d'avancement final de la réaction d'un acide sur l'eau, dépend de la nature de l'acide et des conditions initiales :
Classés par ordre de réactivité sur l'eau, nous
trouvons l'acide chlorhydrique (taux = 1) qui réagit totalement,
puis l'acide méthanoïque, puis l'acide éthanoïque
(réactions d'équilibre).
Pour ces 2 derniers, le taux d'avancement final augmente lorsqu'on
dilue les acides.
Nous dirons que l'acide chlorhydrique est plus fort que l'acide méthanoïque, lui-même plus fort que l'acide éthanoïque. L'acide chlorhydrique est appelé acide fort, les autres acides faibles.
Mais peut-on comparer l'acide chlorhydrique et l'acide sulfurique, qui tous deux ont un taux de 1 ? Oui. L'acide sulfurique (concentré) versé sur la forme basique de l'acide chlorhydrique, c'est à dire des ions chlorure (chlorure de sodium, ou sel de mer, solide), produit un dégagement de vapeurs d'acide chlorhydrique. C'est pour cela que l'acide chlorhydrique est parfois appelé "esprit de sel". Cela prouve que l'acide sulfurique est le plus fort des deux. Cette transformation chimique a été autrefois employée pour fabriquer l'acide chlorhydrique, l'acide sulfurique étant produit par la combustion du soufre.
Le programme officiel fait à juste titre remarquer que la terminologie "acide fort", "acide faible" est ambiguë : Elle est parfois reliée à la valeur du Ka du couple acide / base mis en jeu, en comparaison avec ceux de l'eau et parfois au fait que la réaction sur l'eau est totale ou non.
A titre d'exemple, effectuons le calcul pour 1 des résultats
expérimentaux obtenus : CH3COOH et eau, concentration
apportée, 5 .10-2 mol . L-1. Conductance
mesurée 370 mS = 370 . 10-6
S, avec une cellule de constante K = 1,05 cm-1.
Notons que la constante de cellule K est exprimée en cm-1,
c'est à dire qu'elle indique L / S (attention, certains livres appellent
constante de cellule, la grandeur inverse, vérifiez à l'aide
des unités). Calculons la valeur de K, dans le système international
d'unités. Nous pouvons par exemple, en inscrivant les unités
au milieu du calcul (à l'américaine) écrire :
L / S = 1,05 cm-1 = 1,05 cm / 1 cm2 (les électrodes
ont des dimensions de cet ordre effectivement) = 1,05 .10-2
m / 1 .10-4 m2 = 1,05 . 10+2 m-1.
La conductivité de la solution, obtenue à partir
de la relation G = s .
S
/
L est donc : s=
G
. L / S ou encore s=
370
. 10-6 . 1,05 . 10+2 = 0,0389 S . m-1,
à comparer à la valeur tabulée 0,038626 S . m-1.
La conductivité nous permet de calculer la concentration
à l'équilibre, en ions oxonium et éthanoate par la
méthode suivante :
De la relation s = lCH3CO2-
. [CH3COO-] + lH3O+
. [H3O+]
qui devient s = (lCH3CO2-
+ lH3O+) . [H3O+]
nous déduisons [H3O+] = s
/ (lCH3CO2- + lH3O+)
d'où [H3O+] = 0,0389 / (4,09 . 10-3
+
35,0 . 10-3 ) ; [H3O+] = 0,90 mol . m-3
= 0,90 . 10-3 mol . L-1.
Le quotient de réaction à l'équilibre, Qr, équilibre vaut donc (0,90 . 10-3 . 0,90 . 10-3) / (5 .10-2 - 0,90 . 10-3 ) = 1,6 .10-5.
| Concentration apportée, en mol . L-1 | 5.10-2 | 10-2 | 5.10-3 | 10-3 | 5.10-4 | 10-4 |
| Conductivité tabulée en S . m-1. | 0,11701 | 0,050439 | 0,034697 | 0,013829 | 0,0089854 | 0,0028852 |
Nous avons vérifié expérimentalement (et cela
peut être justifié sur un plan théorique), que dans
l'état d'équilibre, le quotient de réaction, Qr,
équ, prend une valeur indépendante des concentrations
initiales. Cette valeur dépend de la température. Cette valeur
à l'équilibre, Qr, équilibre, est appelée
constante d'équilibre K.
| A chaque équation de réaction est associée
une constante d'équilibre K = Qr, équilibre.
Pour une réaction en solution aqueuse d'équation a A + b B = c C + d D, K = [C]céquilibre . [D]déquil / ([A]aéquil . [B]béquil) K dépend de la température. |
| Le taux d'avancement final d'une réaction dépend
de sa constante d'équilibre ;
le taux d'avancement final dépend aussi de l'état initial du système (concentrations initiales). |
Pour vous convaincre de la première affirmation, comparez, à concentration apportée égale, les réactions acide éthanoïque eau et acide méthanoïque eau. Pour vous convaincre de la deuxième, examinez le taux d'avancement final de la réaction acide éthanoïque eau, pour différentes concentrations initiales.
Pages 132 et suivantes, exercices : 7 (difficile), 8 (difficile,
serait plus facile à comprendre après étude des domaines
de prédominance), 9, 11, 12.
A 25 ° C, le pH d'une eau parfaitement pure est mesuré
égal à 7.
// Dans le laboratoire de notre lycée, le pH de l'eau distillée que nous préparons valait entre 3 et 4. Nous avons depuis installé des armoires ventilées en permanence, éliminé les réserves excessives d'acide chlorhydrique (nous en avions un bidon de 30 L, acheté pour bénéficier de prix de gros). Le pH de notre eau distillée a augmenté de 2 unités. Cela a amélioré aussi nos TP sur l'acide éthanoïque, qui ressemblaient, pour les flacons anciens, au problème du vinaigre frelaté.
L'eau pure contient donc des ions oxonium, produits par la réaction
d'autoprotolyse de l'eau :
H2O + H2O = H3O+ + HO-
Le taux d'avancement final de cette réaction est très
faible : 1 L d'eau contient 1000 / 18 = 55,5 mol d'eau. Pour 1 L, l'avancement
maximal (non atteint !) est de 55,5 / 2 = 27,8 mol. L'avancement final
est de 10-pH, soit 10-7 mol. Le taux d'avancement
final de cette réaction est donc 10-7 / 27,8 = 3,6 .
10-9.
Calculons la constante d'équilibre associée à cette réaction, appelée
| produit ionique de l'eau Ke :
Ke = [H3O+] . [HO-]. Ke = 10-14. (à 25 °C). |
// Notez l'analogie avec la définition du pH (p peut signifier - log et H, la concentration en ions oxonium).
A 25 ° C, une solution neutre a un pH de 7, une solution acide
un pH inférieur à 7, une solution basique un pH supérieur
à 7.
Notez qu'une solution neutre contient autant d'ions hydroxyde que d'ions
oxonium.
Exercice : Calculons le pH d'une solution contenant des ions oxonium à la concentration de 4 . 10-3 mol . L-1 et d'une autre contenant des ions hydroxyde à la concentration de 4 . 10-3 mol . L-1.
Réponse : Pour la première, pH = - log[H3O+]
= - log(4 . 10-3) = 2,4.
Pour l'autre : [H3O+] =
10-14 / [HO-] = 2,5 . 10-12 , et pH =
- log(2,5 . 10-12) = 11,6.
La réaction de mise en solution d'un acide dans l'eau possède
une constante d'équilibre associée, appelée constante
d'acidité, Ka.
Exemple : HA + H2O = H3O+ + A- est associée à Ka = [H3O+] . [A-] / [HA].
| pKA = - log KA. |
Pour le couple H3O+ / H2O , correspondant
à la (surprenante) équation H3O+
+ H2O = H2O + H3O+, Ka
= [H3O+] / [H3O+], soit Ka
= 1 et pKa = 0.
Pour le couple H2O / HO-, correspondant à l'équation H2O + H2O = HO- + H3O+, Ka = [H3O+] . [HO-], soit Ka = Ke = 10-14 et pKa = 14.
Voici quelques exemples de valeurs de pKa :
| Couple acido-basique | HCl / Cl- | H3O+ / H2O | CH3COOH / CH3COO- | H2O / HO- | NH3 / NH2- |
| pKa | - 6,3 | 0 | 4,7 | 14 | 33 |
Comparons divers acides, de même concentration apportée,
dans l'eau (voir les résultats du travail pratique précédent)
:
| Pour des solutions aqueuses d'acides de même
concentration apportée, lorsque la constante d'acidité Ka
croît,
le pH diminue, le taux d'avancement final t augmente, la dissociation de l'acide augmente. |
Comparons diverses bases, de même concentration apportée,
dans l'eau :
Vous admettrez les résultats suivants, en remarquant qu'un acide
réagit d'autant plus sur l'eau que sa constante d'acidité
est forte ; alors qu'une base réagit d'autant plus avec l'eau que
sa constante d'acidité est faible (elle a un caractère plus
basique, donc moins acide).
| Pour des solutions aqueuses de bases de même
concentration apportée, lorsque la constante d'acidité Ka
décroît,
le pH augmente, le taux d'avancement final t augmente, la protonation de la base augmente. |
Considérons la réaction acido-basique entre l'acide
benzoïque et l'ion éthanoate, en solution dans l'eau :
C6H5COOH + CH3COO- = C6H5COO-
+ CH3COOH. Par définition, le quotient de réaction
qui lui est associé est :
Qr = [C6H5COO-] . [CH3COOH]
/ ([C6H5COOH] . [CH3COO-]).
En multipliant numérateur et dénominateur par la même
expression [H3O+] (Note : retenez cette
astuce de calcul qui reviendra souvent), il vient :
Qr = [C6H5COO-] . [CH3COOH] . [H3O+] / ([C6H5COOH] . [CH3COO-] . [H3O+]).
Si vous considérez la valeur que cette expression prend à
l'équilibre (en fait, dans ce type de réaction, l'équilibre
est atteint très rapidement), vous devez reconnaître la constante
d'acidité Ka1 de l'acide benzoïque et l'inverse
de la constante d'acidité Ka2 de l'acide éthanoïque.
Donc à la réaction acido-basique entre un acide et une base,
en solution dans l'eau est associée une constante d'équilibre
K = Ka1 / Ka2.
Vous devrez être capable de redémontrer cette relation.
Donc ne l'appliquez pas sans discernement.
Rappelons la définition de la constante d'acidité,
Ka :
Dans l'exemple : HA + H2O = H3O+ +
A-, Ka = [H3O+] . [A-]
/ [HA].
Prenons le logarithme décimal de cette expression :
log Ka = log [H3O+] + log ( [A-]
/ [HA]).
ou encore : - log [H3O+] = - log Ka
+ log ( [A-] / [HA]), donc :
| pH = pKa + log ( [A-] / [HA])
ou pH = pKa + log ( [Forme basique] / [Forme acide]) |
Supposons un couple acido-basique en solution dans l'eau, le pH étant imposé, par ajout d'une autre base ou d'un autre acide. La relation précédente reste toujours valable pour le couple. Donc :
 |
Figure 3 |
Un indicateur coloré acido-basique est un couple acide /
base, dont les teintes des espèces conjuguées sont différentes.
A condition d'en verser une très faible quantité, le pH est
celui imposé par le milieu réactionnel. La figure 3 nous
montre que lorsque le pH imposé est égal au pKa de l'indicateur,
les concentrations de ses 2 espèces sont égales. L'indicateur
prend sa teinte sensible. Pour pH < pKa - 1, l'espèce acide est
nettement prédominante, l'indicateur prend la teinte de sa forme
acide... En résumé (et en simplifiant) :
| pH < pKa - 1 : Teinte de la forme acide,
pKa - 1 < pH < pKa + 1 : teinte sensible, pKa + 1 < pH : Teinte de la forme basique. |
Nous allons étudier les titrages pH-métriques d'un
acide ou d'une base dans l'eau, en vue de déterminer le volume versé
à l'équivalence et de choisir un indicateur coloré
acido-basique approprié au titrage.
Cela permet de déterminer la concentration apportée de
cet acide ou de cette base. Nous vérifierons que la réaction
acido-basique retenue est bien totale.
Voici 2 exemples de courbes qui peuvent être obtenues lors
d'un titrage. En noir, évolution du pH, en fonction du volume v
de réactif titrant versé, en magenta, la dérivée
dpH / dv.
 |
Figure 4 : Titrage d'une solution d'acide éthanoïque par une solution de soude. |
| L'équivalence est atteinte lorsque les 2 réactifs sont apportés dans les conditions stchiométriques. Avant l'équivalence, le réactif HO- est limitant, après c'est CH3COOH qui le devient. L'équivalence correspond au changement de réactif limitant. |
 |
Figure 5 : Titrage d'une solution d'ammoniac, par une solution d'acide chlorhydrique. |
Lors d'un dosage acido-basique, l'équivalence correspond
au point de la courbe pH = f (vtitrant) pour lequel la dérivée
dpH / dvtitrant passe par un extremum (maximum pour la figure
4, minimum pour la 5).
Tracez 2 tangentes à la courbe, parallèles entre elles
et inclinées d'environ 45 °. Tracez ensuite la droite équidistante
de ces 2 tangentes. Elle coupe la courbe pH = f (v) au point d'équivalence.
Pour qu'un indicateur coloré acido-basique convienne à
un titrage, sa zone de virage (teinte sensible) doit contenir le pH à
l'équivalence.
Considérons le titrage d'une solution d'acide éthanoïque
(Va = 10 mL, ca = 1,3 . 10-2 mol . L-1.) par une
solution de soude de concentration cb = 1 . 10-2 mol . L-1.
Étudions le milieu réactionnel, pour un volume de soude versé,
vb = 4 mL.
| Équation | CH3COOH + | HO- = | CH3COO- + | H2O |
| État initial en mol | ca . va = 1,3 . 10-4 | cb . vb = 4 . 10-5 | 0 | Excès |
| État final en mol | 1,3 . 10-4 - xfinal | 4 . 10-5 - xfinal | xfinal | Excès |
| Le taux d'avancement final de la réaction de titrage
est égal à 1.
La réaction est totale. |
En dehors des questions de qualité de la solution titrante
et de soin dans les manipulations, le titrage sera d'autant plus précis
que le saut de pH autour de l'équivalence sera important. Des solutions
plus concentrées donnent un saut plus important. Voyez par exemple
la figure suivante représentant le titrage de solutions d'acide
éthanoïque de concentrations 10-1, 10-2,10-3,10-4
mol . L-1, par de la soude de même concentration.
Le réactif titrant sera soit une base forte (exemple : soude),
soit un acide fort (exemples : acide chlorhydrique, acide sulfurique qui
est un diacide).
 |
Mais le programme officiel fait à juste titre remarquer que cette terminologie est ambiguë : Elle est parfois reliée à la valeur du Ka du couple acide / base mis en jeu, en comparaison avec ceux de l'eau et parfois au fait que la réaction sur l'eau est totale ou non. |
Au bureau : 1 L d'une solution de Britton - Robinson S, constituée par un mélange d'acides : 12,5 mL d'acide phosphorique à 1,0 mol . L-1, 12,5 mL d'acide éthanoïque à 1,0 mol . L-1 et 125 mL d'acide borique à 0,10 mol . L-1, complétés à 1 L ; 1 L de solution de soude à 0,10 mol . L-1, 100 mL de solution de bleu de bromothymol, à 0,025 % ou 4 . 10-4 mol . L-1, réalisée en dissolvant 25 mg de BBT dans 100 mL d'éthanol ; 2 pipetteurs ; 1 pipette jaugée de 1 mL (ou, plus commode, 1 liquipette de 1 mL, pipette aspirante souple et jetable), 1 pipette jaugée de 20 mL. Solutions tampons de pH 7 et 4 et 2 verres à pied, plus 2 grands béchers servant de poubelle. Réserve d'eau distillée, essuie-tout, morceaux de papier filtre. Bidon de récupération des déchets liquides non organiques.
La formule chimique du BBT est C27 H28 Br2 O5 S, sa masse molaire est de 624 g . mol-1. 25 mg dans 100 mL correspondent à un pourcentage de 0,025 % ou une concentration de 4 . 10-4 mol . L-1.
Pour chaque groupe de 2 élèves : 1 burette graduée,
2 béchers de 100 mL, 1 verre ordinaire bien lourd pour empêcher
le renversement du bécher, un agitateur magnétique, un barreau
aimanté, un colorimètre, 1 filtre coloré jaune correspondant
à l = 620 nm (à défaut,
1 filtre 590 nm voire 580 nm ; la firme Jeulin ne propose pas de filtres
à 620 nm, mais des filtres à 590 nm), 1 voltmètre
numérique, 1 pH-mètre. Il est souhaitable de disposer d'un
support pour la sonde pH-métrique.
// Note : Le protocole employé donne des résultats
acceptables avec le filtre à 580 nm, dans la mesure où nous
admettons que le "blanc" est fait avec une concentration nulle en espèce
basique, et qu'à la fin, vers pH = 11, seule l'espèce basique
reste présente. Le plus ennuyeux est la largeur de bande du filtre,
d'environ 50 nm, placée sur le flanc de la bosse d'absorbance et
non pas autour du sommet. Car la somme de plusieurs fonctions exponentielles
n'est pas une exponentielle.
Précautions expérimentales : Vous ne devez pas placer vos doigts sur les faces utiles de la cuve à chromatographie ; repérez d'un point de feutre ou de blanc judicieusement placé le côté de la cuve placé face à la source lumineuse. Veillez à ne pas tout renverser ; placez votre bécher dans un verre à pied assez lourd, quand nécessaire. Méfiez-vous du poids de la sonde ph-métrique. Veillez à ne pas faire couler la soude sur la sonde, ni sur les bords du bécher.
Vous allez ensuite mesurer le pH du mélange placé dans
le bécher, mesurer son absorbance, replacer dans le bécher
le prélèvement ayant servi à la mesure d'absorbance,
ajouter un petit volume de soude et recommencer.
Remplissez le tableau suivant. Les volumes de soude ajoutés
sont indicatifs ; vous devez suivre l'évolution du pH et resserrer
les points, de pH 5,5 à pH 8 (vous devrez alors verser moins d'un
demi millitre à la fois) :
| Volume total de soude versé, en mL (pour correction des concentrations et absorbances) | 0 | 0,5 | 1,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | .... |
| Couleur du mélange | ||||||||||
| pH mesuré | ||||||||||
| Absorbance mesurée | ||||||||||
| Volume total du mélange, en mL (pour correction des concentrations et absorbances) | ||||||||||
| Absorbance, corrigée de l'augmentation de volume, qui correspondrait à 22 mL | ||||||||||
| Concentration de la forme basique, exprimée en pourcentage | ||||||||||
| Concentration de la forme acide, exprimée en pourcentage |
Tracez le diagramme de distribution en pourcentage, des espèces
acide et basique constituant le BBT, en fonction du pH.
Indiquez sur ce diagramme les différents domaines de prédominance.
Indiquez sur ce diagramme la zone de virage du BBT observée.
Coloriez-la éventuellement.
Comparez cette zone à ce qui est dit dans le cours.
Trouvez sur ce diagramme le pKa du couple acido-basique constituant
le BBT.
Pour un volume total de 22 et de 27 mL (volume de solution de soude
ajouté égal à 0 puis 5 mL), calculez les concentrations
en espèces acide et basique de l'indicateur coloré.
Si vous disposez d'un ordinateur :
Aide pour les tracés dans Excel : Pour tracer
les courbes tabulées déduites de la relation pH = pKa + log([forme
basique] / [forme acide]), il se pose un problème : Comment trouver
la relation [forme basique], ou [forme acide] =f (pH) ? En fait, il est
inutile d'inverser la fonction. Le plus simple est de placer à gauche
une colonne provisoirement vide pour les pH, de remplir une première
colonne de concentrations en plaçant les nombres 100 et 98 (ou 100
et 99) dans les 2 premières cellules, puis en incrémentant,
de déduire par une formule la deuxième colonne de concentrations,
puis de passer à la formule du pH, en ayant pris soin de déclarer
le pKa comme une constante. La première (concentrations 100 et 0)
et la dernière cellule (concentrations 0 et 100) de la colonne de
pH seront modifiées à la main. Il suffira d'y porter les
valeurs extrêmes de pH mesurées. Les 2 courbes tabulées
seront tracées avec des segments de droites ou de courbes.
Il faudra ensuite ajouter les points de mesure (la
manière
de procéder est expliquée sur ce site, dans les pages
MPI, Excel). A ce stade, ils seront eux aussi représentés
par des courbes les joignant. Faites alors : Double clic sur ces courbes
à modifier, Clic droit | Format de série de données
| Trait | Aucun ; Marque | Personnalisée.
Voici les résultats expérimentaux obtenus par un groupe
d'élèves (d'autres ont obtenu de moins bons résultats
: nombre de points insuffisant dans la zone intéressante). La correspondance
avec la théorie est excellente. On note une concentration négative
due à une maladresse de manipulation. Accès au fichier
Excel du TP.
Le diagramme de distribution obtenu expérimentalement (points)
et la courbe tabulée correspondant à un pKa de 7,05, donnée
par le logiciel AcBasPH disponible sur ce site.

Voici, à titre d'information, la courbe pH = f (log([base] /
[acide])), où les premiers et derniers points ont été
éliminés (0 n'a pas de logarithme et ne peut être diviseur).
La pente du segment de droite ajustant la courbe est de 1,06 au lieu de
1 ; le pKa est trouvé égal à 7,059.

Le pKa tabulé du BBT est selon les sources de :
A partir de la courbe obtenue lors du TP précédent,
choisissez l'indicateur coloré le plus approprié à
ce titrage. Réalisez-le 2 fois : d'abord en versant rapidement l'aide
chlorhydrique pour trouver un ordre de grandeur du volume versé
à l'équivalence, une deuxième fois en versant l'acide
rapidement, loin de l'équivalence puis goutte à goutte jusqu'à
l'équivalence.
// Note pour le professeur : En commençant par
cette méthode, vous saurez rapidement si les solutions employées
ont les concentrations attendues.
Au bureau : 1 flacon de produit déboucheur, 3 pipettes jaugées
de 10 mL, 3 pipetteurs, 1 fiole jaugée de 1 L, 4 verres à
pied. Solutions tampons de pH 7 et 4, plus 2 grands béchers servant
de poubelle. 1 L de solution d'acide chlorhydrique à 0,1 mol . L-1.
Réserve d'eau distillée, essuie-tout, morceaux de papier
filtre. Bidon de récupération des déchets liquides
non organiques.
Par poste de 2 élèves : 1 burette graduée, 1 éprouvette graduée de 100 mL, 1 agitateur magnétique, 1 bécher de 250 mL, 1 pH-mètre, choix d'indicateurs colorés, 2 verres ou béchers servant de poubelle. Éventuellement, 1 conductimètre.
// Note : La soude concentrée est responsable de nombreux et accidents domestiques (destruction du tube digestif). Compte tenu de sa faible efficacité pour le débouchage des éviers, le plus raisonnable est de ne jamais en posséder chez soi. Les produits de débouchage, pas plus efficaces, contiennent de l'ammoniac, destiné à repousser les enfants et sont vilainement colorés.
Diluez le produit déboucheur 100 fois. Comment faut-il procéder
?
// Note : Cela peut être fait une seule fois, au bureau.
Prélevez, avec précision, 10 mL de déboucheur
dilué ; complétez ce volume à 100 mL avec de l'eau
distillée, avec une précision moyenne (emploi de l'éprouvette
graduée), dans un bécher et titrez-le à l'aide d'acide
chlorhydrique. Pour cela, versez l'acide chlorhydrique, mL par mL, en relevant
le pH mesuré et éventuellement la conductance. A l'approche
du saut de pH, ajoutez l'acide par demi millilitre. Après le saut
de pH, versez par millilitre.
Tracez la courbe pH = f (volume d'acide versé).
Trouvez sur cette courbe le volume équivalent. Rappelez les
méthodes possibles.
Calculez la masse de soude contenue dans 1 L de déboucheur.
Réfléchissez à la question suivante : vaut-il mieux
raisonner sur les 10 mL prélevés, ou sur les 100 mL versés
dans le bécher ?
Vérifiez la justesse des indications figurant sur l'étiquette.
Données : On lit sur l'étiquette du Yplon (déboucheur PPX ou premier prix) : Densité 1,2 ; pourcentage massique en hydroxyde de sodium 20 % (note : Au laboratoire, l'hydroxyde de sodium est appelé soude ; dans l'industrie, la soude est le carbonate de sodium).
Nous donnons à titre de simple exemple, une courbe simulée
(solution de soude versée sur solution d'acide éthanoïque),
obtenue à partir du logiciel AcBasePH,
disponible sur ce site.
Pour que la courbe simulée et la courbe expérimentale
se rapprochent de segments de droites, il faut faire en sorte que le volume
du milieu réactionnel varie peu lors de l'ajout de soude. L'acide
est donc choisi environ 10 fois plus dilué que la soude, et le volume
d'acide placé dans le bécher vaut ici 100 mL.

// Note pour le professeur : Les élèves, lorsqu'ils tracent leur courbe expérimentale, ont tendance à relier tous les points, en dessinant un arrondi au niveau du volume équivalent. Il est vrai qu'il est surprenant de trouver par cette méthode le volume équivalent, alors qu'aucune mesure n'a, à priori, été faite pour ce volume. Le même phénomène se produit pour les dosages calorimétriques, par exemple, dosage de l'acide phosphorique par la soude.
Deuxième semaine : Pages 168 et suivantes : Exercices
9 (calcul de constante de réaction acido-basique), 12 (prédominance),
15 (diagramme de prédominance), 22 (type bac).