Sommaire : Espèce chimique, consignes de
sécurité pour la vie de tous les jours, dangers des espèces
chimiques, espèces chimiques organiques ou inorganiques, solubilité,
espèces naturelles ou synthétiques, travail pratique : analyse
d'un soda à l'orange.
Toute matière constituée de molécules identiques
est appelée espèce chimique.
L'analyse chimique permet d'attribuer un nom et une formule à une espèce chimique.
Seules les espèces présentes dans les produits alimentaires
peuvent être senties ou goûtées.
Espèces dangereuses, trouvées dans le commerce, ou produites par certaines activités humaines :
| Eau de Javel | provoque de graves brûlures |
| Monoxyde de carbone | provoque des asphyxies mortelles, même à faible dose |
| Soude pour déboucher les éviers | provoque de graves brûlures, responsable de nombreux accidents domestiques aux conséquences très graves. Ne devrait pas être employée, tant son utilité est faible et ses dangers redoutables. |
| Essence | les vapeurs sont extrêmement inflammables et explosives. |
L'eau de Javel et la soude doivent être conditionnées dans
des emballages spéciaux et être mis hors de portée
des enfants. Ne
stocker un produit chimique dans une bouteille ordinaire, car
cela conduira un jour à un accident.
Bannir la lessive de soude et les autres 'déboucheurs' d'éviers,
moins efficaces qu'une simple ventouse et responsables de nombreux drames
: une gorgée avalée par erreur entraîne la destruction
de l'sophage et de l'estomac et une invalidité définitive
!
Dessinez sur votre cahier les symboles :
Inflammable, corrosif, nocif ou irritant, toxique.
Les espèces chimiques dont la combustion conduit à
la formation de dioxyde de carbone et d'eau, sont appelées organiques.
Exemples d'espèces organiques : Cellulose (papier, bois), Nylon, aspirine...
Exemples d'espèces inorganiques : Fer, chlorure de sodium, carbonate de calcium, silice...
Le sucre est soluble dans l'eau. Il se dissout dans
l'eau, l'eau est le solvant, le sucre est le soluté.
| Les substances synthétiques sont celles fabriquées par l'homme. Les substances artificielles sont les substances synthétiques qui n'existent pas dans la nature. |
Pages 22 et suivantes, exercices n° 3, 6, 9, 17, 20.
| Vue | Toucher | goût | odorat | |
| est colorée | ||||
| est odorante | ||||
| contient des gaz | ||||
| contient de l'eau | ||||
| est acide | ||||
| est sucrée | ||||
| est salée | ||||
| est grasse |
8.2.1. Versez une goutte de soda sur
du sulfate de cuivre anhydre. Employez pour cela une pipette et une coupelle.
Décrivez vos observations, interprétez le résultat.
8.2.2. Déposez une goutte de soda sur du papier pH. Décrivez vos observations, interprétez le résultat.
8.2.3. Introduisez environ 3 mL de soda dans un tube à essais et ajoutez 1 mL de liqueur de Felhing. Chauffez modérement. Décrivez vos observations, interprétez le résultat.
8.2.4. Introduisez 4 mL de soda dans un tube à essais et placez sur le tube un dispositif à dégagement ; chauffez doucement le tube et faites dégager un gaz éventuel dans un deuxième tube rempli à moitié d'eau de chaux. Auparavant, réflechissez aux risques éventuels. Décrivez vos observations, interprétez le résultat.
Ces résultats sont-ils en concordance avec ceux du premier
paragraphe ?
La plupart des canettes de boisson sont en fer ou en aluminium.
Proposez un test permettant de déterminer l'espèce chimique
constituant l'emballage. Décrivez vos observations, interprétez
le résultat.
Cette espèce chimique est-elle naturelle, synthétique, artificielle ?
Sommaire : Techniques de séparation, solvant,
soluté, caractérisation d'une espèce chimique, séparation
et caractérisation par chromatographie, travail pratique : hydrodistillation
de la lavande, travail pratique : chromatographie sur papier.
Expression : exemple, presser une orange.
Décantation : exemple, traitement de l'eau ; en limitant l'agitation, en réduisant la vitesse de l'eau, les particules solides en suspension se déposent.
Filtration.
Décantation liquide | liquide : pour séparer des liquides non miscibles.
Décoction : exemple, tisane. Voir extraction par solvant.
Distillation, hydrodistillation, voir le travail pratique.
// alambic et alcool sont des mots d'origine arabe.
Extraction par solvant. La décoction utilise l'eau comme solvant.
| Définition : La masse volumique d'un corps (homogène) est numériquement égale au quotient de la masse de ce corps, par son volume. |
masse volumique = masse / volume.
masse volumique s'exprime en kg . m -3,
masse en kg et volume en m 3.
On dit parfois : La masse volumique d'un corps est égale au
quotient de la masse de ce corps, par son volume.
C'est un raccourci. Diviser une masse par un volume n'a aucun sens
; ce sont les nombres mesurant la masse et le volume qu'on divise.
La densité d'un corps solide ou liquide par rapport à
l'eau est le rapport des masses volumiques de ce corps et de l'eau. La
densité n'a pas d'unité.
Lorsque deux liquides non miscibles sont mélangés, le moins dense surnage : il constitue la phase supérieure.
La concentration massique d'un soluté dans un solvant est
numériquement égale au quotient de la masse du soluté,
par le volume de la solution. Elle se mesure en kg / m 3, ou
en g / L.
La solubilité d'une espèce dans un solvant est égale à sa concentration dans une solution saturée.
Un corps pur est caractérisé par des constantes physiques
:
Pages 38 et suivantes, exercices n° 9, 15, 16, 17, 18.
Matériel nécessaire, chauffe ballon, ballon, colonne
de Vigreux, condenseur, bécher ou erlenmeyer, support, ampoule à
décanter.
// Note : Vous trouverez sur ce site d'autres exemples
de chromatographie sur papier, peu coûteuse et attrayante (et aussi
formatrice !).
Sirop de menthe (4 gouttes, avec séchage au sêche-cheveux entre chaque dépot de goutte), éluant eau salée.
Feutres à l'eau plus eau.
Dans un lot de feutres de couleur, vérifiez si chaque couleur est pure ou constituée d'un mélange ; retrouvez les espèces chimiques communes à différentes couleurs.
Sommaire : La chimie de synthèse, exemples
de synthèse en chimie lourde, exemples de synthèse en chimie
fine, transformation chimique, travail pratique : synthèse d'une
espèce chimique odorante.
La chimie lourde : Synthèse en peu d'étapes de grandes
quantités de produits, à partir de matières premières
facilement disponibles.
La chimie fine : Elle utilise comme réactifs des produits de la chimie lourde et des extraits naturels. Elle est à haute valeur ajoutée.
En chimie organique : Le polyéthylène est obtenu à
partir de l'éthylène ou éthène C2
H4. La France en produit 1,4 million de tonnes par an ; le prix
de revient est de 1 Euro par kg.
En chimie minérale : La France produit 600 000 tonnes d'aluminium par an, à partir de la bauxite. Le prix de revient en est de 1,5 Euro par kg.
La vanilline, l'aspirine.
Réactifs -> produits.
Pages 51 et suivantes, exercices n° 6, 8, 10.
Dans un tube à essai, versez 5 mL d'acide acétique,
5 mL de pentan - 1 - ol. Ajoutez avec beaucoup de précautions deux
gouttes d'acide sulfurique concentré. Placez sur le tube à
essai un condenseur formé d'un tube en verre enfoncé dans
un bouchon. Prenez le tube à l'aide de pinces en bois et plongez-le
dans un bain marie pendant quelques minutes. Ouvrez le tube. Avez vous
synthétisé une espèce chimique ? A quoi vous fait-elle
penser ?
Les élèves doivent travailler debout. L'acide sulfurique
peut être fourni dans un tout petit flacon compte gouttes, plein
seulement à moitié. Méfiance, en ce début d'année,
les élèves de seconde sont extrêmement maladroits.
Ils sont parfaitement capables de presser trop fort sur le compte gouttes,
simplement en le prenant, et de projeter de l'acide !
C'est l'occasion de leur montrer comment sentir avec précaution
l'acide éthanoïque et d'attirer leur attention sur le fait
qu'un produit concentré, voire pur, peut être beaucoup plus
dangereux que le même produit dilué dans de l'eau (vinaigre).
Le professeur pourra synthétiser au bureau, avec un matériel plus sophistiqué, un ester à odeur de banane (10 mL d'acide acétique pur et 10 mL d'alcool isoamylique). Ajouter quelques gouttes d'acide sulfurique concentré et quelques grains de pierre ponce. Du sulfate de cuivre anhydre permettra de montrer que de l'eau s'est formée.
Sommaire : Structure de l'atome, le noyau, les
électrons, les ions, l'élément chimique, isotopes,
notation, cortège électronique, travail pratique : l'élément
cuivre.
1.1. Un atome est électriquement neutre. Il est constitué
d'un noyau chargé positivement et d'électrons chargés
négativement, en mouvement autour du noyau.
Il est constitué par l'assemblage de particules appelées
nucléons :
Le nombre de nucléons est appelé nombre de masse A, le nombre de protons (ou nombre de charge) est appelé numéro atomique Z.
L'électron porte une charge exactement opposée à
celle du proton. Sa masse est 1800 fois plus faible que celle du proton.
Dans un atome (neutre) il y a autant d'électrons que de protons.
La masse d'un atome contenant A nucléons est pratiquement
égale à A . mp, où mp est la
masse du proton. Pour obtenir un résultat plus précis, une
simple addition ne suffit pas. La taille de l'atome est d'environ 10 -10
m. En proportion, le noyau correspond à une tête d'épingle
au milieu d'un terrain de sport. L'atome a une structure lacunaire.
En perdant des électrons, un atome se transforme en ion positif
ou cation ; en gagnant des électrons, en ion négatif ou anion.
Le noyau de l'atome n'est pas modifié, seul le cortège électronique
change.
Un élément chimique (représenté par
des atomes ou des ions) est caractérisé par le numéro
atomique Z. Tous les atomes d'un élément ont le même
cortège électronique et les mêmes propriétés
chimiques.
Des isotopes ont le même numéro atomique ; il correspondent
donc au même élément. Ils diffèrent par leur
nombre de masse A ; ils ont donc des masses différentes (et des
propriétés nucléaires différentes).
Les électrons se répartissent en couches, caractérisées
par un nombre (quantique) n. n = 1 correspond à la couche K, n =
2 à la couche L...
Principe d'exclusion de Pauli : Chaque couche ne peut contenir qu'un
nombre limité d'électrons ( = 2 . n 2).
Dans l'état le plus stable, les électrons occupent les
couches correspondant aux nombres n les plus faibles.
// Couches internes, couches externes.
Pages 70 et suivantes, exercices n° 13, 14, 15, 16, 17, 19,
26, 25.
Remarque : La difficulté pédagogique de ce travail
pratique vient de ce que les noms des différentes espèces
chimiques que les élèves vont former, contiennent tous le
mot cuivre ; dès lors, il n'est pas surprenant que l'élément
cuivre s'y trouve toujours. On peut envisager de réaliser les premières
expériences, et de faire les premiers bilans, sans prononcer les
noms des espèces, mais en les appelant solution bleue, précipité
bleu, précipité noir...
Les atomes de cuivre sont transformés en ions cuivre (II),
Cu 2+, qui se dispersent dans la solution qui prend une couleur
bleue.
Versons de la soude dans une solution de sulfate de cuivre. Il est
possible même d'employer la solution bleue obtenue au paragraphe
précédent, mais comme elle contient beaucoup d'acide nitrique,
il faudra verser beaucoup de soude. Peut-être faire l'expérience
sur un seul des tubes à essai du groupe qui expérimente en
travaux pratiques. Nous obtenons un précipité bleu d'hydroxyde
de cuivre (II). Chauffons cet hydroxyde, nous obtenons de l'oxyde de cuivre
(II), solide noir.
Cu (OH)2 -> Cu O + H2O
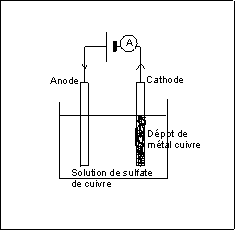
Réaction à la cathode, électrode par laquelle
le courant sort de la cuve à électrolyse :
Cu 2+ + 2 e- -> Cu
La solution se décolore (prendre de la paille de fer). Par
addition de soude, nous obtenons un précipité verdâtre
d'hydroxyde de fer (II).
Cu 2+ + Fe -> Cu + Fe 2+
Fe 2+ + 2 OH- -> Fe (OH) 2
Par chauffage dans une flamme, le métal cuivre réagit
avec le dioxygène de l'air en donnant un solide noir, le dioxyde
de cuivre (II) :
Nous obtenons du cuivre métal.
// Le fusain destiné au dessin donne de bons résultats.
// L'eau de chaux se trouble(rait). Attention au risque de reflux d'eau
froide dans le tube à essai bouillant !
2 Cu O + C -> 2 Cu + C O 2
Au cours de toutes ces réactions, l'élément
cuivre a ... disparu, puis est ... réapparu, ... par enchantement,
par miracle...
// C'est un gag qui marche à tout coup ; il est amusant d'observer
les réactions progressives des élèves, à mesure
qu'ils copient cette sottise. Étant obligés à passer
du blanc sur le texte faux, retiendront-ils mieux cette loi ?
Au cours de toutes ces réactions, l'élément cuivre s'est conservé.
Sommaire : Gaz nobles, règle de l'octet
et du duet, ions monoatomiques, molécules, représentation
de Lewis, géométrie des molécules, représentation
de Cram, isomères, travail pratique.
L'hélium, le néon... sont chimiquement inertes. Ceci
est dû à leur structure électronique externe, en duet
pour l'hélium et en octet pour les autres.
Au cours des réactions chimiques, les atomes ont
tendance à adopter la structure électronique externe de l'atome
de gaz noble dont le numéro atomique est voisin : octet ou duet.
Pour cela, ils peuvent
|
Considérons la réaction du chlore et du sodium, donnant
un solide ionique, le chlorure de sodium :
Sodium : Z = 11. Sa formule électronique est (K)2 (L)8 (M)1 ;
Chlore : Z = 17, formule : (K)2 (L)8 (M)7.
Ils deviennent :
Ion sodium Na +, (K)2 (L)8 et ion chlorure Cl -, (K)2 (L)8 (M)8.
Une molécule est électriquement neutre et formée
d'un nombre limité d'atomes.
|
|
|
|
|
|
| Formule brute | Représentation de Lewis |
Un doublet liant et trois doublets non liants, sur l'atome de chlore.
Une liaison double et deux fois deux doublets non liants (sur chaque
atome d'oxygène).
Le nombre de liaisons covalentes qu'établit un atome est
généralement égal au nombre d'électrons qui
lui manquent pour acquérir une structure électronique en
octet ou en duet.
Dans cette représentation, le symbole de l'atome représente
son noyau et ses électrons internes.
Premièrement : Additionner le nombre d'électrons périphériques
de chaque atome, pour connaître le nombre de doublets.
Deuxièmement : Répartir ces doublets en liants et non liants, pour respecter les règles de l'octet et du duet, pour chaque atome. Cela donne la représentation de Lewis.
Troisièmement : Les doublets d'électrons externes d'un atome se repoussent. cela donne la géométrie de la molécule. 4 doublets adoptent une disposition tétraédrique.
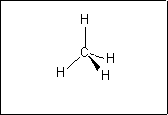
H : 1 doublet liant,
C : 4 doublets liants,
N : 1 doublet non liant et 3 doublets liants,
O : 2 doublets non liants et 2 doublets liants,
Cl : 3 doublets non liants et 1 doublet liant.
On appelle isomères des espèces chimiques qui ont
la même formule brute, mais des enchaînements d'atomes différents.
Exemple, éthanol et méthoxyméthane.
Formules développées,
formules semi-développées : C H 3 C H 2 O H et C H 3 O C H 3.
Leurs propriétés chimiques et physiques sont différentes.
Pages 86 et suivantes, exercices n° 10, 11, 14, 16, 19, 22,
26, 29.
A l'aide du logiciel ChemSketch
(C'est un freeware que vous pouvez vous procurer sur Internet, voir notre
chapitre de bonnes adresses)
construisez ou dessinez les molécules suivantes :
H 2 | O 2 | H 2 O | C H 4
| C 2 H 6 | C 2 H 5 O H | C
O 2.
Vérifiez la correction des formules, visualisez ces molécules
en trois dimensions. Mesurez la taille de la molécule de dihydrogène,
mesurez les angles de la molécule de méthane.
Prouvez que les propriétés physiques de l'éthanol et du méthoxyméthane sont différentes.
// Problème personnel : ChemSketch admet deux structures différentes pour la molécule S O 2, avec des propriétés physiques différentes. O S 2 existe-t-il ? ChemSketch dit que oui.