A - La transformation d'un
système chimique est-elle toujours rapide ?
2 Transformations rapides ou lentes ; 3 Suivi temporel
d'une transformation ; 4 Quelle interprétation donner au niveau
microscopique ?
B - La transformation d'un
système chimique est-elle toujours totale ?
5 Une transformation chimique n'est pas toujours totale
et la réaction a lieu dans les deux sens ; 6 État d'équilibre
d'un système, quotient de réaction, constante d'équilibre
; 7 Transformations associées à des réactions acido-basiques
en solution aqueuse, constante d'acidité
Sur cette page
Exemples pris dans les sciences de l'ingénieur
et dans les sciences de la vie (4 TP, 7 heures classe entière)
Note importante : Dans cette leçon,
nous nous attacherons à trouver le sens spontané d'évolution
d'un système, sans nous préoccuper de considérations
cinétiques. Il se peut donc qu'une transformation spontanée
soit tellement lente qu'elle ne nous apparaisse pas.
| Qr = [C]c . [D]d / ([A]a . [B]b) |
Où seules les espèces chimiques solubles sont prises en compte ; l'eau (ou les autres solvants) n'est pas prise en compte, les phases solides ne sont pas non plus prises en compte.
Matériel nécessaire : Au bureau, flacons
de 1 L d'acide éthanoïque, d'éthanoate de sodium, d'acide
méthanoïque, de méthanoate de sodium de concentration
précisément égale à 0,01 mol . L-1.
Veillez à employer des bases non carbonatées. 4 pipettes
jaugées de 10 mL, 4 de 1 mL, 8 pipetteurs, 3 verres à pied
pour étalonnage des pH-mètres, solutions tampon pH 7 et pH
4, morceaux de papier filtre, essuie-tout, réserve d'eau distillée,
robinet, bidons à récupération.
Pour 8 groupes de 2 élèves : 1 pH-mètre, 1 pissette d'eau distillée, 6 béchers (ou verres ordinaires), 1 verre à pied pour ranger la sonde du pH-mètre.
Protocole 1 : Voici les pKa de 2 couples acido basiques :
Acide éthanoïque CH3COOH, ion éthanoate,
appelé couple a1, b1 : pKa1 = 4,8 ;
Acide méthanoïque HCOOH, ion méthanoate, appelé
couple a2, b2 : pKa2 = 3,8 ;
Réalisez successivement les solutions suivantes, avec une aussi
grande précision que possible, et mesurez leur pH :
Protocole 2 : Réalisez successivement les solutions suivantes, avec une précision moyenne, et mesurez leur pH :
En résumé Qr initial = 1 conduit à Qr final = K = 10, le système évoluant dans le sens direct de l'équation. Qr initial = 100 conduit à Qr final = K = 10, le système évoluant dans le sens inverse de l'équation.
// Note provisoire : Le programme officiel
propose dans ses exemples d'activités, mélange de solutions
d'ions fer (II), d'ions fer (III), d'ions iodure et de diiode ; mélange
de solutions d'ions fer (II), d'ions cuivre (III), de poudre de fer et
de poudre de cuivre. La première expérience me gène
un peu, car elle conduit à employer dans les calculs, des concentrations
en ions iodure et en diiode, alors qu'il a été expliqué
précédemment aux élèves que le diiode, en présence
d'ions iodure donne des ions triiodure. De plus, faute d'avoir vu un travail
pratique complet et qui "marche", il me paraît difficile d'observer
les deux sens de transformation.
La deuxième sera retenue et faute d'avoir trouvé
un travail pratique complet et qui "marche", je propose provisoirement
les expériences suivantes :
| Un système chimique évolue spontanément vers un
état d'équilibre, tel que le quotient de réaction
final soit égal à la constante d'équilibre K.
Si le quotient de réaction initial Qr initial , calculé à partir des concentrations apportées (c'est à dire calculées en supposant qu'aucune réaction n'a encore eu lieu) est inférieur à K, le système évolue dans le sens direct d'écriture de l'équation. Si Qr initial est supérieur à K, le système évolue dans le sens inverse de l'équation. Si Qr initial est égal à K, le système n'évolue pas. |
Page 190 et suivantes, exercices : 9 et 10 (documentaires, qualitatifs),
11 (complexation), 12 (sulfate de baryum), 18 (estérification),
23 (solubilité de l'acide benzoïque dans l'eau), 25 (type bac,
conductimétrie).
Plaçons dans le même bécher 2 solutions contenant
des ions Fe(II) et Cu(II), approximativement aux mêmes concentrations,
ainsi qu'un morceau de cuivre et un morceau de fer. Nous constatons que
le métal fer se recouvre de métal cuivre, et par comparaison
avec une expérience de la leçon
précédente, qu'il se forme des ions Fe(II) et que des ions
Cu(II) disparaissent.
La constante d'équilibre associée à l'équation
Cu2+ + Fe = Fe2+ + Cu, vaut 2,8 . 1026.
Or le quotient de réaction initial était proche de 1. Le
système a donc évolué dans le sens direct de l'écriture
de l'équation de la réaction. Nous constatons qu'il y a eu
transfert d'électrons de l'élément (sous forme métal)
fer, vers l'élément (sous forme ionique) cuivre. L'élément
fer passe de la forme métal à la forme ionique ; l'élément
cuivre passe lui de la forme ionique à la forme métal.
Une expérience similaire peut être réalisée
en remplaçant l'élément fer, par l'élément
zinc. En ce cas, la constante d'équilibre associée à
l'équation Cu2+ + Zn = Zn2+ + Cu, vaut 1,9
. 1037.
Vous avez étudié, en classe de première scientifique,
ce type de transfert.
Montage : Plaçons dans 1 bécher un morceau de
fer métal et une solution contenant des ions fer (II). Nous avons
réalisé une demi-pile. Plaçons dans
un autre bécher un morceau de cuivre métal et une solution
contenant des ions cuivre (II) ; relions les 2 béchers par un pont
salin, morceau de papier filtre qui va s'imprégner des 2
solutions par capillarité, et raccordons les 2 électrodes,
fer et cuivre à un circuit électrique comportant une résistance
de 1000 W, 1 ampèremètre et 1
voltmètre.
Constatations : Nous observons un passage de courant électrique, à travers la résistance, depuis l'électrode en cuivre, vers celle en fer. Le cuivre est à un potentiel plus élevé que le fer (d.d.p. cuivre-fer positive).
Interprétation : Dans la résistance (et aussi l'ampèremètre,
les fils, les plaques métalliques), des électrons circulent,
du fer vers le cuivre (le sens conventionnel du courant est donc du cuivre,
borne + de la pile, vers le fer, borne -). Comme dans l'expérience
précédente, où toutes les espèces chimiques
étaient mélangées.
Dans les solutions de sulfate de cuivre et de sulfate de fer, il y
a déplacements d'ions. Les ions cuivre et fer, positifs, circulent
dans le sens conventionnel du courant, donc du - vers le + à l'intérieur
de la pile. Les ions sulfate, négatifs, circulent en sens inverse.
Le pont salin assure la continuité du circuit électrique
; il permet le passage du courant par déplacement des ions qu'il
contient (dans le sens conventionnel à l'intérieur d'une
pile).
Les électrons sortant de l'électrode en
fer proviennent de l'oxydation du fer selon la demi équation : Fe
= Fe2+ + 2 é.
Les électrons qui arrivent dans l'électrode en cuivre
produisent une réduction des ions cuivre (II) présent dans
la solution en métal cuivre, selon : Cu2+ + 2 é
= Cu.
Le bilan est le même que lors du transfert d'électrons
entre espèces chimiques mélangées.
Protocole : Mesurez la force électromotrice de cette pile, puis l'intensité maximale qu'elle peut débiter (rappelez les précautions d'usage d'un ampèremètre). Pour quelle raison cette intensité est-elle si faible ? Modifiez votre montage pour augmenter cette intensitée débitée. Cette pile pourrait-elle alimenter une lampe de poche, une calculatrice électronique ? Cette intensité correspondant à la limite de sensibilité de notre ampèremètre numérique, proposez une autre technique de mesure employant la boite de résistances et un voltmètre.
Tracez la caractéristique U = f (I) de cette pile. Vous pourrez pour cela utiliser des valeurs R de résistances de la boite AOIP branchée sur la pile, tournant autour de 50000W. Trouvez la résistance interne de cette pile.
Réponses : Cette pile a une f.é.m.
de 1,06 V et une résistance interne très grande aux alentours
de 50000W. Il faut réduire le plus possible
la longueur du pont salin. Pour mesurer des intensités aussi faibles,
il est possible de mesurer la tension aux bornes d'une résistance
AOIP, R branchée sur la pile et d'appliquer la loi d'Ohm. Les mesures
seront valides tant que la résistance R de la boite AOIP sera très
inférieure à celle du voltmètre, aux environs de 100
MW. La tension U aux bornes de la pile est de
la forme U = E - r . I. E est mesurée au voltmètre numérique,
avec une bonne précision, compte tenu de la résistance de
celui-ci. r peut être trouvée graphiquement, ou par régression
linéaire à l'aide d'une calculatrice (même de type
collège). Apprenez à utiliser cette fonction utile. r peut
être trouvée autrement : C'est la valeur de la résistance
R de la boite AOIP qui conduit à U = E / 2.
| L'électrode où se produit la réduction est appelée cathode. L'électrode où se produit l'oxydation est appelée anode. |
// Remarquez que réduction et cathode commencent par une consonne, oxydation et anode par une voyelle.
// Note pour le professeur : Dans certains métaux, les porteurs de charge sont positifs et ne sont donc pas des électrons.
Note 1 pour les élèves : Vous devrez être capable d'interpréter le fonctionnement d'une pile en disposant d'une information parmi les suivantes : sens de circulation du courant électrique, f.é.m., réactions aux électrodes, polarité des électrodes, mouvement des porteurs de charge.
Un voltmètre électronique, branché aux bornes
d'une pile, permet de mesurer sa force électromotrice E.
La f.é.m. de la pile est la tension entre ses bornes, lorsque la pile ne débite pas de courant. Vous avez vu en classe de première que lorsque la pile débite une certaine intensité, la tension entre ses bornes est inférieure à la f.é.m.
Lors de l'évolution spontanée, la valeur du quotient de réaction tend vers la constante d'équilibre. La f.é.m. tend vers 0. A l'équilibre, la pile est usée.
Rappelons la relation entre intensité I d'un courant électrique,
en ampère, charge électrique Q transportée, en coulomb,
et durée t de passage du courant en seconde : Q = I . t.
Si l'intensité I n'est pas constante, il faut soit prendre la
valeur moyenne de l'intensité, soit réduire la durée
de mesure. La relation devient : DQ = I . Dt,
et à la limite, dQ = I . dt.
Lorsqu'une mole d'espèce chimique est transformée dans
la pile, il circule dans le circuit une charge électrique égale
à n . F,
où F est
le symbole du faraday, et n le nombre d'électrons intervenant dans
la demi-équation concernant cette espèce chimique.
Le faraday, est la valeur absolue de la charge électrique
d'une mole d'électrons, F
= NA
. e.
NA
est la constante d'Avogadro, e est la charge élémentaire,
valeur absolue de la charge de l'électron, et F
= 96500 C.
Note 2 pour les élèves : Vous devrez être capable d'utiliser ces relations, par exemple calculer une quantité d'électricité débitée par une pile connaissant la diminution, ou l'augmentation, de la masse d'une électrode (principe des premiers compteurs électriques). Ces relations sont aussi applicables aux électrolyses. La pile est usée lorsque le réactif limitant a été consommé.
Lire page 206, exemples de piles usuelles et page 209, les piles
"grand public".
Pages 211 et suivantes, exercices 8 (montage correct de 2 demi-piles),
11 (note 1 pour les élèves), 22 (type bac, note 2 pour les
élèves), 21 (thème documentaire, pile à combustible).
Matériel nécessaire : Solutions de sulfate
de cuivre et de sulfate de fer à 0,1 mol . L-1, morceau
de cuivre, morceau de fer, 3 béchers, papier filtre et ciseaux,
2 pinces crocodile, fils électriques, 1 voltmètre, 1 ampèremètre
sensible, 1 boîte de résistances type AOIP, 1 générateur
de tension continue constante, ajustable à partir de 0 V (exemple,
petites alimentations ELC jaunes, 0 - 15 V, ou alimentation Jeulin - 15
V, + 15 V).
Montage : Placez dans 1 bécher un morceau de fer métal
et une solution contenant des ions fer (II). Placez dans un autre bécher
un morceau de cuivre métal et une solution contenant des ions cuivre
(II) ; reliez les 2 béchers par un pont salin, morceau
de papier filtre qui va s'imprégner des 2 solutions par capillarité,
et raccordez les 2 électrodes, fer et cuivre à un circuit
électrique comportant une résistance de 1000 W,
1 ampèremètre et 1 voltmètre. Ajoutez dans ce circuit
le générateur de tension continue constante (d'abord réglé
sur 0 V), dans un sens tel qu'il permette d'inverser le sens du courant.
Faites un tableau dans lequel vous relèverez l'intensité
du courant électrique traversant le circuit, avec son sens, pour
diverses valeurs de la tension délivrée par le générateur
(inspirez-vous du travail pratique précédent).
Lorsque le sens du courant a été inversé, indiquez
le sens de déplacement des divers porteurs de charges, les signes
des deux électrodes et les transformations chimiques qui s'y produisent.
Où a lieu une réduction, une oxydation ? Où sont l'anode
et la cathode ? Voyez-vous des applications à une telle transformation
forcée ?
// Application : Les piles rechargeables, les accumulateurs.
Rappel :
| L'électrode où se produit la réduction est appelée cathode. L'électrode où se produit l'oxydation est appelée anode. |
Matériel nécessaire : Solution saturée
de sel de mer, tube en U avec 2 bouchons percés, traversés
par une électrode en graphite. 2 pinces crocodile, fils, 1 générateur
de tension continue constante, ajustable à partir de 0 V, 1 voltmètre,
1 ampèremètre, solution d'indigo (1 cartouche d'encre bleue
empruntée à un stylo à encre suffit), phénolphtaléine.
Protocole : Remplissez partiellement le tube en U de solution de chlorure de sodium. Du côté de l'électrode positive, ajoutez, sans agiter quelques gouttes d'encre. De l'autre côté, versez quelques gouttes de phénolphtaléine. Fermez le circuit électrique. Augmentez progressivement la tension, pour observer un passage du courant électrique.
Observations : Faites un schéma de ce que vous observez.
Le gaz qui se dégage sur l'électrode positive semble-t-il
soluble dans l'eau ? Quelle est sa nature (si vous essayez de le sentir,
soyez très prudent, il s'agit d'un gaz qui peut être mortel)
?
Quel est le caractère des ions qui se forment sur l'autre électrode
? Essayez de prouver la nature du gaz qui s'y dégage, à l'aide
d'une bûchette présentant un point incandescent. A la fin
de l'électrolyse, agitez le tube en U, pour mélanger les
produits qui se sont formés sur les 2 électrodes. Sentez
prudemment le mélange. Quelle est sa nature ? Écrivez les
équations des transformations chimiques qui se sont produites.
// Application : La fabrication de la soude et de l'eau
de Javel.
|
|
Apparus en 1860, ils représentent actuellement
65 % du marché. Ils sont dus à Gaston Planté.
Chaque élément, de f.é.m. 2 V, comporte
une électrode en plomb et une autre en plomb recouvert d'oxyde de
plomb PbO2, qui baignent dans une solution aqueuse d'acide sulfurique
à 6 mol . L-1 (concentrée, donc dangereuse) et
de sulfate de plomb. La réaction spontanée de décharge
de l'accumulateur s'écrit :
PbO2 + 4 H+ + Pb = 2 Pb2+
+ 2 H2O.
La réaction de charge est : 2 Pb2+
+ 2 H2O = PbO2 + 4 H+ + Pb.
Question : L'électrode en plomb est-elle anode ou cathode, lors de la charge, lors de la décharge ?
Il s'agit de déposer une couche métallique
sur un objet, par électrolyse.
La respiration correspond à une réaction
spontanée de dégradation de matière organique, dans
laquelle intervient l'oxygène. Elle fournit de l'eau et du dioxyde
de carbone, ainsi que de l'énergie. La dégradation d'une
mole de glucose (180 g) fournit 2,9 millions de joules, selon l'équation
: C6H12O6 + 6 O2 = 6 CO2
+ 6 H2O.
Lors de la photosynthèse, les cellules végétales
captent l'énergie solaire, par l'intermédiaire de la chlorophylle.
Cela leur permet la synthèse (entre autres) du glucose, selon l'équation
: 6 CO2 + 6 H2O = C6H12O6
+ 6 O2.
Page 231 et suivantes, exercices 8 (électrolyse
du sulfate de cuivre), 13 (zingage par électrolyse), 19 (type bac,
calcul de la masse de cadmium métal produite par électrolyse).
D - Comment le chimiste contrôle-t-il
les transformations de la matière ?
Exemples pris dans les sciences de l'ingénieur
et dans les sciences de la vie (4 TP, 7 heures classe entière)
Matériel nécessaire : Au bureau (entre parenthèses,
quantité à prélever par chaque groupe d'élèves),
acide éthanoïque pur (15 mL), alcool benzylique C6H5-CH2-OH
(10 mL) (-> éthanoate de benzyle, ester à odeur de jasmin
- paraît-il car le produit que nous avons obtenu évoque de
l'odeur de jasmin, uniquement la partie "agressive", entêtante),
ou acide éthanoïque pur (11,5 mL), alcool isoamylique ou
3-méthylbutanol (22 mL) (-> acétate d'isoamyle ou éthanoate
de 3 - méthylbutyle),
flacon de grains de pierre ponce, 2 petits flacons compte goutte en
plastique contenant de l'acide sulfurique concentré, 2 éprouvettes
graduées de 25 mL, 2 bouteilles de solution de sel saturée,
solution d'hydrogénocarbonate de sodium à 1 mol . L-1,
sulfate de magnésium anhydre, 1 spatule, éluant à
chromatographie : acétate d'éthyle et cyclohexane, 1 lampe
à U.V., éthanoate de benzyle, 1 verre de montre, capillaires
(ou piques à apéritif), sèche cheveux.
Pour chaque groupe : 1 chauffe ballon à thermostat (indispensable, sinon les produits et réactifs seront calcinés), 1 ballon, 1 réfrigérant monté à reflux, 1 paire de lunettes, 1 ampoule à décanter et son support, 1 erlenmeyer, 1 cuve à chromatographie, 1 plaque à chromatographie sensible aux U.V.,
Protocole : Réfléchissez aux règles de sécurité
à respecter (lunettes, travail debout, précautions lors de
la manipulation de l'acide sulfurique concentré...). Dans le ballon,
introduisez les volumes indiqués d'acide carboxylique et d'alcool,
5 gouttes d'acide sulfurique concentré, quelques grains de pierre
ponce. Chauffez à reflux, à ébullition douce pendant
une demi heure. Observez le reflux, évaluez par toucher la température
de la colonne à reflux, en différents points. N'oubliez-pas
la circulation d'eau. Aucune vapeur ne doit s'échapper de la colonne.
Éteignez le chauffe ballon, versez doucement dans le ballon
50 mL de solution salée. récupérez le tout dans l'ampoule
à décanter, éliminez la phase aqueuse, puis ajoutez
50 mL de solution d'hydrogénocarbonate de sodium. Agitez avec précaution.
Inutile d'arroser vos voisins. Éliminez la phase aqueuse. Recueillez
la phase organique dans un erlenmeyer, ajoutez quelques spatules de sulfate
de magnésium anhydre.
Comparez par chromatographie le produit obtenu, l'alcool benzylique
et l'éthanoate de benzyle.
Interprétation : Rédigez un compte rendu rappelant les consignes de sécurité. Écrivez l'équation de la transformation qui a lieu en présence de l'hydrogénocarbonate de sodium. Interprétez le chromatogramme. Écrivez l'équation de la réaction d'estérification. est-elle totale ?
Un ester possède le groupe 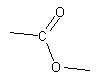 .
.
L'un des atomes d'oxygène est doublement lié au carbone
fonctionnel, l'autre doit être lié à un autre atome
de carbone (et pas à un hydrogène, sans quoi il s'agirait
d'un acide carboxylique).
| Le nom d'un ester est formé de deux termes :
Le premier, avec le suffixe -oate, désigne la chaîne provenant de l'acide carboxylique. Le deuxième, avec le suffixe -yle, est le nom du groupe alkyle de l'alcool. Les deux chaînes sont numérotées à partir de l'atome de carbone fonctionnel. |
Un ester peut être obtenu par réaction d'un acide carboxylique
avec un alcool, selon l'équation :
RCOOH + R'OH = RCOOR' + H2O.
// acide + alcool = ester + eau
La réaction d'estérification est lente et limitée. Les ions H+ sont catalyseur de cette réaction.
L'eau hydrolyse tous les esters, en donnant un acide carboxylique
et un alcool, selon l'équation :
RCOOR' + H2O = RCOOH + R'OH.
La réaction d'hydrolyse est lente et limitée. Les ions H+ sont catalyseur de cette réaction. C'est la réaction inverse de la réaction d'estérification.
// Hydrolyse : Coupure par action de l'eau.
Ces deux réactions sont inverse l'une de l'autre. Elles ont
lieu simultanément, ce qui conduit à un état d'équilibre.
A l'équilibre, la vitesse de formation de l'ester par estérification
est égale à sa vitesse de disparition par hydrolyse.
Écrivons pour la réaction d'estérification une
constante d'équilibre, K = [ester]équilibre .
[eau]éq / ([acide]éq . [alcool]éq).
// Note : Admettons que nous ayions le droit de le faire
! L'eau n'est pas le solvant, donc sa concentration figure dans l'expression.
Mais l'ester étant insoluble dans l'eau, que signifie [ester] ???
Certains ouvrages s'en "sortent" en remplaçant les concentrations
fictives par les quantités de matière, mais la loi ainsi
énoncée ne fait l'objet d'aucune justification.
Supposons que nous soyions parvenu à un état d'équilibre. Que se passe-t-il si nous éliminons un des produits (ester ou eau), ou du moins, si nous diminuons sa concentration ? Nous voyons que le quotient de réaction devient inférieur à la constante d'équilibre, donc que la réaction se produit dans le sens direct ; il y a production d'ester. Nous obtenons le même résultat en augmentant la concentration de l'un des réactifs, alcool ou acide carboxylique.
Le rendement d'une réaction chimique est égal au rapport
de la quantité d'un produit effectivement obtenue à la quantité
qui aurait été produite, si la transformation avait été
totale. Le rendement est égal au taux d'avancement (final, si le
chimiste a la patience d'attendre que l'équilibre chimique soit
atteint).
Supposons par exemple, que les conditions initiales permettent de prévoir
la formation de 100 g d'ester, dans le cas d'un avancement maximal. Si
nous n'en obtenons que 60 g, le rendement est de 60 %.
Le rendement des estérifications dépend très peu de l'acide carboxylique employé. Il dépend par contre nettement de la classe de l'alcool :
L'expérience montre que pour les réactions d'estérification
- hydrolyse, la constante d'équilibre ne dépend pas de la
température. Une élévation de température permet
d'atteindre plus rapidement l'équilibre, mais ne modifie pas celui-ci.
| Un catalyseur est une espèce qui augmente la vitesse d'une réaction
chimique. Le catalyseur ne figure pas dans l'équation de la réaction,
car il se retrouve inchangé à la fin de celle-ci.
Un catalyseur ne modifie pas l'état d'équilibre du système chimique, car il accélère la réaction directe et la réaction inverse. Un catalyseur est spécifique à une réaction, car il modifie le mécanisme de celle-ci. |
Vous avez déjà rencontré une espèce chimique jouant le rôle de catalyseur, lors d'un travail pratique de cinétique. Rappelons de quoi il s'agissait.
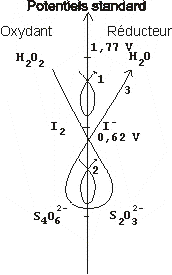 Réaction
1 : Lente ; c'est celle que nous étudions.
Réaction
1 : Lente ; c'est celle que nous étudions.
Réaction 2 : Rapide ; elle nous sert à doser la
quantité de diiode formé, lors de la réaction 1.
Réaction 3 : Très lente ; ce qui nous permettra
une astuce expérimentale.
Si maintenant nous nous intéressons à la réaction 3 très lente, nous constatons qu'elle est accélérée (réaction 1) par l'apport en ions iodure, lesquels sont régénérés par la réaction 2.
Un catalyseur est sélectif. Ainsi, en faisant passer des
vapeurs d'éthanol sur du cuivre à 250 °C, on obtient
de l'éthanal ; en les faisant passer sur de l'alumine à 400
°C, on obtient de l'éthylène.
En choisissant le catalyseur, le chimiste pourra orienter une transformation
chimique.
Matériel nécessaire : 1 bécher de 100
mL, 1 appareil de chauffage (bec Bunsen ou plaque électrique), solution
de sel de Seignette à 60 g . L-1, eau oxygénée
110 volumes, chlorure ou sulfate de cobalt (II) à 0,3 mol. L-1.
Protocole : Versez dans le bécher environ 30 mL de solution
de sel de Seignette (tartrate de sodium et de potassium, contenant les
ions tartrate -OOC-CHOH-CHOH-COO-). Ajoutez avec
précaution environ 2 mL d'eau oxygénée à 110
volumes. Vérifiez qu'à la température ordinaire, aucune
réaction n'est perceptible. Chauffez à environ 70 ° C.
Observez un faible dégagement gazeux. Ajoutez 2 mL de solution contenant
des ions cobalt (II).
Au bout de quelques secondes, la réaction s'accélère.
Lorsqu'elle cesse, vous pouvez ajouter à nouveau 2 mL d'eau oxygénée.
Observez que
Matériel nécessaire : Eau oxygénée
110 volumes, solution concentrée de chlorure de fer (III), de chlorure
de fer (II), bûchettes, allumettes, morceaux de foie, lamelles de
navet, béchers. Éponge.
Protocole : L'eau oxygénée se décompose
lentement à température ambiante, selon l'équation
: 2 H2O2 = 2 H2O + O2.
Montrez qu'il s'agit d'une réaction d'oxydo réduction,
écrivez les deux couples mis en jeu, justifiez le terme de dismutation.
Cette dismutation est rendue plus rapide par la présence d'un catalyseur.
Répartissez un mélange de 10 mL d'eau oxygénée
et de 30 mL d'eau, dans 2 béchers. Ajoutez dans l'un 1 goutte, puis
1 mL de solution concentrée de chlorure de fer (III). Comparez,
prévoyez une éponge pour les débordements.
Refaites la même expérience avec des ions fer (II). Observez
la couleur finale des solutions.
Dans un bécher contenant quelques mL d'eau oxygénée,
introduisez une pincée de sable.
Dans un bécher contenant 20 mL d'eau oxygénée
et 20 mL d'eau, mettez un morceau de foie, ou une lamelle de navet (moins
efficace).
Les enzymes sont des catalyseurs très efficaces. La catalase
est 106 fois plus efficace que les ions fer (III), pour la décomposition
de l'eau oxygénée.
Page 253 et suivantes, exercices : 14 (isomères), 16 (identification),
22 (hydrolyse, avancement), 26 (type bac, Dean - Stark).
Matériel nécessaire : 1 bécher, 1 ballon
avec réfrigérant, 1 chauffe ballon, anhydride éthanoïque,
éthanol, eau salée.
Protocole : Le même que lors de la synthèse d'un ester, mais sans catalyseur. Chauffez 10 minutes. Versez de l'eau salée dans le ballon et récupérez les produits dans un bécher.
Observation : Un ester s'est formé, l'éthanoate d'éthyle.
Il s'agit d'une réaction (assez) rapide et totale, d'équation
: 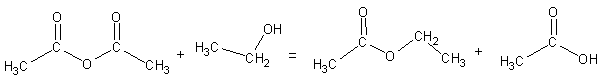
Un anhydride d'acide est nettement plus réactif que l'acide carboxylique
correspondant.
// Note : Le programme officiel considère cette
réaction comme rapide.
// Méthode mnémotechnique : Un anhydride peut être considéré comme l'assemblage de 2 molécules d'acide, avec élimination d'une molécule d'eau. Lors de l'estérification, l'eau n'apparaît donc pas (la réaction peut donc être totale) et la deuxième molécule d'acide se retrouve dans les produits (sa réaction avec l'alcool est trop lente).
Il s'agit d'une réaction (assez) rapide et totale, d'équation
:
R - COO - R' + HO- = R - COO- + R' - OH.
Elle permet de préparer industriellement, à partir de
substances naturelles, des alcools et des acides carboxyliques (Remarquez
que le deuxième membre de l'équation comporte la forme basique
d'un tel acide. Sa forme acide apparaît si on impose une diminution
du pH). Elle sert essentiellement à fabriquer des savons.
// Note : Le programme officiel considère cette
réaction comme rapide.
Un savon est un mélange de carboxylates de sodium ou de potassium,
dont les chaînes carbonées sont non ramifiées et possèdent
plus de 10 atomes de carbone.
En solution dans l'eau, un carboxylate de sodium s'écrit : R - COO- + Na+. En toute rigueur, lorsque le savon est solide, sans présence d'eau, on devrait écrire sa formule : R - COONa, puisqu'on ne fait pas apparaître les charges dans l'écriture des solides ioniques. La première notation sera tolérée.
Les savons sont obtenus par saponification de triglycérides, corps nommés esters gras, d'origine naturelle. Pour des raisons de commodité, écrivons la formule du triglycéride sur 3 lignes :
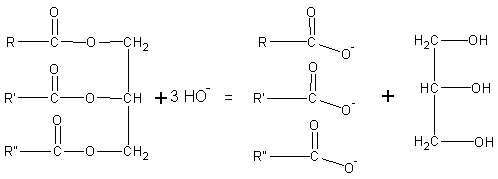
Matériel nécessaire : Ballon et chauffe ballon, avec réfrigérant monté à reflux, bouteille d'huile, soude en pastilles ou lessive de soude, eau saturée en sel, spatules, eau distillée, 3 béchers, tube en verre, solution concentrée de chlorure de calcium, tubes à essai et bouchons.
Protocole : Versez dans le ballon de l'huile et une spatulée
de pastilles de soude. Chauffez doucement 20 minutes. Récupérez
les produits dans un bécher contenant de l'eau saturée en
sel. Cette opération est appelée relargage. Recommencez pour
éliminer un éventuel excès de soude.
Prélevez un fragment de savon, placez-le dans un bécher
contenant de l'eau distillée, dissolvez-le (solution 1) et faites
des bulles en soufflant.
Dans un tube à essai, versez de cette solution 1 et un peu d'huile.
Bouchez.
Dans un tube 2, placez de la solution 1, un peu de chlorure de calcium
et de l'huile.
Dans un tube 3, mettez de l'eau distillée et de l'huile.
Agitez les 3 tubes, laissez reposer et comparez.
Les ions carboxylate R - COO- des savons comportent deux
parties :
Les propriétés détergentes (du latin detergere, nettoyer) du savon sont dues à ce double caractère. Une couche d'ions carboxylate permet de mettre une minuscule gouttelette d'huile en suspension dans l'eau. Deux couches permettent de mettre en suspension une poussière. A la surface de l'eau, une monocouche d'ions peut se former.
Matériel nécessaire : Au bureau, 1 mortier
avec pilon, 1 carré de papier filtre (servant d'entonnoir), 1 cachet
d'aspirine 500 non tamponnée, 1 fiole jaugée de 500 mL, réserve
d'eau distillée, pissette d'eau distillée, solution de soude
à 1,0 . 10-2 mol . L-1, 2 verres à
pied, 2 pipettes jaugées de 20 mL, 2 pipetteurs.
Pour chaque groupe : Phénolphtaléine, burette graduée,
agitateur magnétique, 2 béchers.
Protocole : L'aspirine est de l'acide acétylsalicylique.
C'est un acide faible qui peut être titré par une solution
de soude. Mais la molécule comporte aussi une fonction ester qui
peut réagir sur la soude dans une réaction de saponification.
2 techniques de titrage sont donc possibles : Soit saponifier
la molécule par un excès de soude et mesurer la quantité
d'ions hydroxyde restant après saponification et titrage. Il s'agit
d'un titrage en retour. Soit exploiter la différence de vitesse
de ces 2 réactions, titrage immédiat, saponification assez
rapide à chaud, plus lente à la température ordinaire.
Nous utiliserons la 2° méthode.
Broyez le cachet d'aspirine et mettez-le en solution dans 500 mL d'eau
distillée, sans rien perdre.
Remplissez la burette graduée de solution de soude ; titrez
un prélèvement de 20 mL de solution d'aspirine.
Calculez la masse d'aspirine effectivement présente dans un
cachet. Comparez à l'indication du fabricant.
Page 271 et suivantes, exercices 15 (estérification par anhydride
d'acide), 18 (saponification, calcul de rendement), 23 (type bac, estérification,
rendement). Page 290, exercice 12 (catalyse).
Fin de ce cours personnel de terminale scientifique (qui ne comporte pas la partie spécialité chimie)