Cours de Première S, cinquième page
Page modifiée le 21 / 5 / 2006
La chimie créatrice
Contenu : 9 La chimie organique ; 10 Le squelette
carboné ; 11 Modification
du squelette carboné ; 12 Groupes
caractéristiques, réactivité ; 13 Cohésion
de la matière ; 14 Aspects énergétiques
et effets thermiques.
Extrait
du programme officiel
II. La chimie créatrice
Durée indicative: 11 h de cours, 4 ou 5 TP
A. La chimie organique : de sa naissance à son omniprésence
dans le quotidien
EXEMPLES D'ACTIVITÉS
Travail documentaire* :
- composition des espèces chimiques organiques (importance quantitative
des éléments C et H principalement),
- histoire de la chimie organique sous l'angle des découvertes
et des hommes,
- mise en évidence de la multitude et de la diversité
des molécules en chimie organique (nombre de molécules, nombre
d'espèces organiques synthétisées chaque année,
etc.),
- importance économique de la chimie organique.
CONTENUS
1. Qu'est-ce que la chimie organique?
Cerner le champ de la chimie organique.
Ressources naturelles : photosynthèse, synthèses biochimiques
et hydrocarbures fossiles.
2. Le carbone élément de base de la chimie organique
Comment l'atome de carbone établit-il des liaisons avec d'autres
atomes ?
3. Quelques dates dans l'histoire de la chimie organique
4. L'omniprésence de la chimie organique
CONNAISSANCES ET SAVOIR-FAIRE EXIGIBLES
Savoir que les molécules de la chimie organique sont constituées
principalement des éléments C et H.
À l'aide des règles du « duet » et de l'octet,
décrire les liaisons que peut établir un atome de carbone
avec ses atomes voisins.
B. Apprendre à lire une formule chimique
EXEMPLES D'ACTIVITÉS
Expériences visant à montrer l'importance du squelette
carboné, du groupe caractéristique et leur rôle respectif
sur les propriétés physiques et chimiques : tests de solubilité,
tests de caractérisation.
Travail documentaire de sensibilisation aux différentes représentations
de molécules (y compris des molécules biologiques en lien
avec le programme de SVT) faisant apparaître différents types
de squelettes et faisant émerger la notion de groupe caractéristique*
Éléments de nomenclature, isomérie, (en se limitant
aux alcanes comportant une chaîne de 6 atomes de carbone au plus
et aux molécules de type CHA = CHB), modèles moléculaires
et logiciels de simulation*.
Activités documentaires, utilisation de cédéroms,
vidéos et expériences de cours permettant d'illustrer les
transformations des pétroles (par reformage, craquage catalytique
et vapocraquage) et la polymérisation en spécifiant les produits
obtenus (carburants et polymères) ainsi que leurs nombreuses applications*.
Illustration expérimentale du champ de réactivité
des alcools.
Synthèses permettant de réinvestir et d'acquérir
des techniques expérimentales au laboratoire et d'illustrer la réactivité
de molécules sous l'angle du passage d'un groupe à un autre
avec caractérisation du groupe obtenu.
Applications industrielles.
CONTENUS
1. Introduction
Une molécule organique comporte un squelette carboné
et éventuellement des groupes caractéristiques.
2. Le squelette carboné
a) La diversité des chaînes carbonées
- Chaîne linéaire, ramifiée ou cyclique saturée
et insaturée.
Formule brute, formule semi-développée plane, approche
de l'écriture topologique, isomérie de constitution mise
en évidence sur quelques exemples simples de l'isomérie Z
et E.
- Influence de la chaîne carbonée sur les propriétés
physiques : température d'ébullition, densité, solubilité
(les exemples sont pris sur des chaînes saturées).
- Application à la distillation fractionnée.
b) La modification du squelette carboné
Allonger, raccourcir, ramifier, cycliser, ou déshydrogéner
à partir de quelques applications industrielles :
chimie du pétrole, polyaddition des alcènes et des dérivés
éthyléniques.
3. Les groupes caractéristiques : initiation à la
réactivité
a) Reconnaître les familles de composés : amine, composé
halogéné, alcool, aldéhyde, cétone, acide carboxylique.
b) Illustrer la réactivité des alcools : oxydation, déshydratation
(élimination) passage aux composés halogénés
(substitution).
c) Passage d'un groupe caractéristique à un autre : quelques
exemples au laboratoire et dans l'industrie.
CONNAISSANCES ET SAVOIR-FAIRE EXIGIBLES
Reconnaître une chaîne carbonée saturée linéaire
ou non.
Donner le nom des alcanes (en se limitant aux alcanes comportant une
chaîne de 6 atomes de carbone au plus).
Reconnaître la présence d'une liaison double sur une chaîne
carbonée (alcènes et dérivés éthyléniques).
Donner les formules brute et semi-développée d'une molécule
simple.
Prévoir les isomères de constitution d'une molécule
à partir de sa formule brute (en se limitant aux alcanes comportant
une chaîne de 6 atomes de carbone au plus).
À partir d'un monomère CH2 = CHA, écrire
le motif du polymère obtenu par polyaddition :
-(-CH2-CHA-)-n
Au vu de la formule développée plane d'une molécule,
reconnaître les familles de composés suivantes :
amine, composé halogéné, alcool, aldéhyde,
cétone et acide carboxylique.
Lors de la réaction d'un alcool, reconnaître s'il s'agit
d'une réaction d'oxydation, de déshydratation (élimination)
ou de substitution.
Connaître les familles de composés obtenus par oxydation
ménagée d'un alcool.
Écrire la réaction d'oxydation d'un alcool par les ions
permanganate en milieu acide.
Mettre en œuvre au laboratoire une extraction par solvant, un chauffage
à reflux, une filtration sous vide, une CCM, une distillation en
justifiant du choix du matériel à utiliser.
Déterminer la valeur du rendement d'une synthèse.
III. L'énergie au quotidien :
la cohésion de la matière et les aspects énergétiques
de ses transformations
Durée indicative : 4 h de cours, 1 ou 2 TP
EXEMPLES D'ACTIVITÉS
Observation d'effets thermiques associés à des transformations
chimiques (mettant en jeu des réactions acido-basiques, d'oxydo-réduction,
de dissolution ou de combustion) et à des changements d'état.
Comparaison des ordres de grandeur de l'énergie libérée
au cours d'une réaction de combustion et de l'énergie transférée
au cours d'une réaction de vaporisation.
Applications dans la vie quotidienne des effets thermiques associés
à différentes transformations.
Activités documentaires liées aux combustions par exemple
dans les moteurs à explosion et les centrales thermiques à
flamme (rejets, sécurité, etc.) *.
CONTENUS
1. La cohésion de la matière
La molécule : assemblage d'atomes ; énergie de liaison
d'une liaison AB, notée D AB.
Les assemblages de molécules : le solide et le liquide comparés
au gaz (ordre de grandeur des distances entre les molécules ; de
l'ordre au désordre) ; énergie de cohésion.
2. Les transformations de la matière : aspects énergétiques
et effets thermiques associés
Transformations chimiques.
Changements d'état.
Utiliser les énergies de liaison pour estimer l'ordre de grandeur
de l'énergie transférée au cours d'une réaction
mettant en jeu des espèces chimiques à l'état gazeux.
3. Quelques applications au quotidien des effets thermiques
Transports et chauffage : enjeux et conséquences sur l'environnement.
CONNAISSANCES ET SAVOIR-FAIRE EXIGIBLES
Être capable de donner une définition de l'énergie
de liaison.
Savoir que l'énergie de cohésion de solides ou de liquides
composés de molécules est un ordre de grandeur plus faible
qu'une énergie de liaison.
* Activités pouvant donner lieu
à l'utilisation des technologies de l'information et de la communication.
9. La chimie organique
9.1. Origine de la chimie organique ?
En 1807, le chimiste suédois Berzélius proposa d'appeler
composé organique une espèce chimique fabriquée à
partir d'une matière provenant d'un organisme vivant. En effet,
à cette date, les composés organiques connus avaient tous
cette origine : Colorants tels la pourpre de Tyr (mollusque), l' indigo
(plante), savon (graisse), alcool (fermentation de fruits).
En 1828, le chimiste allemand Wöhler synthétise l'urée,
à partir de substances minérales. La chimie organique n'est
plus la chimie des organismes vivants.
9.2. Définition
Sommairement, nous pouvons dire :
La chimie organique est la chimie des composés du carbone.
// Exceptions : dioxyde et monoxyde de carbone, charbon.
Les composés organiques contiennent, en plus de l'élément
carbone,
généralement de l'hydrogène. On peut aussi
y trouver les éléments oxygène et azote,
plus rarement le soufre, le chlore et le phosphore.
Le pétrole est aujourd'hui la principale matière première
de la chimie organique.
9.3. Tétravalence du carbone
Pour satisfaire à la règle de l'octet (du "duet"
pour la première ligne de la classification périodique),
chaque atome de carbone établit quatre liaisons covalentes. Le carbone
est tétravalent.
Voici la formule brute de l'éthanol C2H6O,
sa formule semi-développée CH3 - CH2-OH,
sa formule développée sa représentation de Lewis
sa représentation de Lewis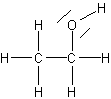 et
sa formule topologique
et
sa formule topologique .
Dans la formule topologique, chaque sommet d'angle et chaque extrémité
de segment correspond à un atome de carbone, sauf si un autre élément
chimique est représenté. Les atomes d'hydrogène liés
aux atomes de carbone ne sont jamais représentés.
.
Dans la formule topologique, chaque sommet d'angle et chaque extrémité
de segment correspond à un atome de carbone, sauf si un autre élément
chimique est représenté. Les atomes d'hydrogène liés
aux atomes de carbone ne sont jamais représentés.
Rappel : L'oxygène est divalent.
| Des isomères sont des espèces chimiques qui ont
même
formule brute, mais des formules développées différentes.
Leurs propriétés physiques et chimiques diffèrent. |
9.4. Importance de la chimie organique
Plusieurs millions de molécules organiques sont identifiées.
Plusieurs milliers de nouvelles sont synthétisées chaque
année. Leur production et leur utilisation s'accompagne de la formation
d'une quantité importante de déchets qu'il faut (ou faudrait)
recycler ou éliminer.
Production française en 1998 :
| Espèce |
éthylène |
benzène |
polystyrène |
P.V.C. |
aspirine |
| Masse en tonnes |
2 900 000 |
900 000 |
720 000 |
1 200 000 |
1 500 |
Leurs usages ne cessent de se diversifier, médicaments, pièces
moulées, isolants, objets en matériaux composites... Donnez
quelques exemples.
9.5. Quelques éléments d'histoire
La préparation de l'éthanol remonte à la préhistoire.
Les Romains et les Phéniciens utilisaient des colorants d'origine
organique, pourpre et indigo. Le savon est fabriqué depuis l'antiquité.
Jusqu'à la synthèse de l'urée en 1828, par Wöhler,
les chimistes croyaient que pour fabriquer ces espèces, il fallait
l'intervention d'une force vitale.
La fin du 19° siècle voit la réalisation d'autres
synthèses (Berthelot), la découverte de la tétravalence
du carbone, la classification des espèces selon leur fonction (alcool,
acide carboxylique...).
Le 20° siècle voit la découverte de la structure
de l'atome, l'apparition de la mécanique quantique, la compréhension
et le suivi des mécanismes réactionnels, l'apparition de
méthodes physiques puissantes pour trouver la structure de molécules
synthétisées, la possibilité de prévoir les
propriétés de nouvelles molécules non encore synthétisées.
9.6. Exercices
Pages 156 et suivantes, exercices 11, 12, 13, 17, 20.
9.7. Travail pratique
9.7.1. Matériel, fiche pour le préparateur
Salle informatique,
logiciel ChemSketch.
9.7.2. Fiche élève
Travail pratique : Chimie organique
Lancez le logiciel ChemSketch.
Faites connaissance de ses possibilités.
Dessinez une molécule de méthane, d'eau et de méthanol.
Demandez le nom de ces molécules.
Visualisez ces molécules en trois dimensions.
Résolvez vos exercices à l'aide de ChemSketch.
Haut
de cette page ? 
10. Le squelette carboné
10.1. Structure d'une molécule organique
Une molécule organique comporte un squelette carboné,
formé par un enchaînement d'atomes de carbone, liés
par des liaisons simples ou doubles.
Sur ce squelette sont parfois fixés des groupes d'atomes comportant
oxygène, azote, chlore, ...groupes qui confèrent à
la molécule des propriétés physiques et chimiques
particulières. Des atomes d'hydrogène permettent que
les valences soient respectées.
Les groupes, ou groupes caractéristiques, définissent
des familles de la chimie organique : alcools, aldéhydes, cétones,
acides carboxyliques, amines, ...
// Question : Pourrait-on envisager des molécules organiques
sans atome de carbone ?
10.2. Différentes chaînes carbonées
Une chaîne carbonée peut être linéaire,
exemple heptane
ramifiée, exemple 3-méthylhexane
ou cyclique, exemple acide benzoïque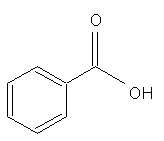
Rappel : Des isomères sont des espèces chimiques
qui ont même formule brute, mais des formules développées
différentes.
Il s'agit d'isomères de constitution. On distingue les isomères
de chaîne, exemple heptane et 3-méthylhexane, les isomères
de position (d'un groupe caractéristique ou d'une double liaison),
exemple le but-2-ène et le but-1-ène, les isomères
de fonction, exemple éthanol  et
méthoxyméthane
et
méthoxyméthane 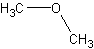 .
.
10.3. Hydrocarbures à chaînes saturées
Un hydrocarbure ne comporte que des atomes de carbone et d'hydrogène.
Il est dit saturé si toutes les liaisons carbone - carbone sont
de simples liaisons. On les classe en alcanes à chaîne linéaire,
alcanes à chaîne ramifiée et cyclanes. Leurs atomes
de carbone sont tétragonaux.
Nomenclature :
Le nom d'un alcane linéaire est constitué d'un
préfixe qui indique le nombre d'atomes de carbone, suivi de la terminaison
-ane.
Méthane, éthane, propane, butane, pentane, hexane, heptane,
octane, ...
En retirant (par la pensée, car l'espèce est très
instable) un hydrogène terminal d'un alcane linéaire, il
apparaît un groupe alkyle, dont le nom s'obtient en remplaçant
la terminaison -ane par la terminaison -yle.
Le nom d'un alcane ramifié est constitué du nom
des ramifications alkyle, précédé de leur indice
de position, suivi du nom de l'alcane linéaire formant la chaîne
principale (la chaîne la plus longue).
Exemple : Le 3-méthylhexane.
La formule brute des alcanes linéaire ou ramifié est CnH2n+2.
Le nom d'un cyclane dérive de celui de l'alcane comportant
le même nombre d'atomes de carbone, avec le préfixe cyclo.
Exemple : Le cyclohexane est un cycle à 6 atomes de carbone.
10.4. Hydrocarbures à chaînes insaturées
Ils comportent une ou plusieurs doubles liaisons carbone - carbone.
Exemple le but-2-ène.
 . Les deux atomes
de carbone doublement liés sont trigonaux.
. Les deux atomes
de carbone doublement liés sont trigonaux.
La double liaison étant rigide, une stéréo-isomérie
peut apparaître.
Exemple :

(E)-but-2-ène et (Z)-but-2-ène. E provient de entgegen
et Z de zusammen, en face et ensemble, en allemand.
Nomenclature :
Le nom d'un alcène comporte la terminaison -ène précédée
de l'indice de position (le plus petit possible) de la double liaison dans
la chaîne principale. Le nom est précédé de
(Z)- ou (E)- si cela est nécessaire.
Caractérisation :
Il est possible d'ajouter une molécule de dibrome sur une molécule
présentant une double liaison. On parle de réaction d'addition.
L'eau de brome se décolore, c'est un test caractéristique.
10.5. Influence de la longueur de la chaîne carbonée
Lorsque les chaînes carbonées s'allongent, généralement,
les composés organiques ont une masse volumique qui augmente, leur
solubilité dans l'eau diminue et leurs températures de changement
d'état augmentent.
Application : La distillation fractionnée.
10.6. Exercices
Page 157 et suivantes, exercices 24 (isomères), 26 (nomenclature),
27 (nomenclature), 31 (isomères).
10.7. Travail pratique
Test caractéristique de la double liaison carbone-carbone dans un
composé organique utilisant une solution de dibrome, réaction
d'addition.
Haut
de cette page ? 
11. Modification du squelette carboné
11.1. Reformage catalytique
Il s'agit de modifier la structure des hydrocarbures comportant
de 5 à 9 atomes de carbone, constituant les essences, afin d'améliorer
leur indice d'octane.
L'isomérisation permet de transformer les alcanes linéaires
en leurs isomères ramifiés.
La cyclisation les transforme en cyclanes, souvent ramifiés,
avec production de dihydrogène.
La déshydrocyclisation fournit des dérivés
aromatiques (exemple benzène).
Toutes ces réactions s'effectuent en présence de catalyseur
(platine).
11.2. Craquage catalytique
Il consiste à casser les molécules des pétroles
lourds en molécules plus petites saturées et non saturées.
11.3. Vapocraquage
Il s'agit d'un craquage d'alcanes en présence de vapeur d'eau
(qui ne figure pas dans le bilan de la transformation chimique). Il permet
d'obtenir des alcènes et du dihydrogène.
11.4. Polymérisation
11.4.1. Définition d'un polymère
Un polymère est une macromolécule formée par
la répétition d'un motif. Le nombre de motifs est appelé
indice ou degré de polymérisation. Il peut être supérieur
à 1000.
Exemple, le polychlorure de vinyle ou P.V.C. -(CH2-CHCl)n-
Les deux extrémités de la longue chaîne peuvent
se terminer par les deux parties d'une molécule d'eau.
11.4.2. Synthèse par polyaddition
La polyaddition consiste en l'addition de molécules comportant
une double liaison C=C.
Exemple :
n CH2=CHA --> -(CH2-CHA)n-
11.4.3. Exemples
Polyéthylène, motif -CH2-CH2-
Polychlorure de vinyle, motif -CH2-CHCl-
Polypropène ou polypropylène, motif  ou -CH2-CH(CH3)-
ou -CH2-CH(CH3)-
Polystyrène, motif 
11.5. Exercices
Page 160, exercice 45 (polymérisation)
Exercice supplémentaire : Déterminez la formule développée
des monomères qui conduisent aux polymères qui suivent :
-(CH2-CH(CN))n-
-(CH2-CH(CO2H))n-
-(CH2-CH(CH3))n-
-(CH2-CH(C6H5))n-
11.6. Travail pratique
Haut
de cette page ? 
12. Groupes caractéristiques, réactivité
12.1. Six familles organiques à connaître
| Famille |
amines |
composés halogénés |
alcools |
composés carbonylés
|
acides carboxyliques |
Groupe
caracté-
ristique |
-NH2
-NH-
-N= |
\\\C-X |
-CH2-OH
=CH-OH
\\\C-OH |
|
-COOH |
Exemples : 2-méthylbutylamine (-NH2), diéthylamine
(=NH), triéthylamine (\\\N).
2-chloro-4-méthylpentane.
3-méthylbutan-1-ol, pentan-2-ol .
3-méthylbutanal.
pentan-2-one.
acide butanoïque.
12.2. Les trois classes d'alcools
L'alcool est dit primaire si l'atome de carbone fonctionnel, tétragonal,
(celui qui porte le groupement hydroxyle-OH) est lié à zéro
ou un atome de carbone.
L'alcool est dit secondaire si l'atome de carbone fonctionnel, tétragonal,
est lié à deux atomes de carbone.
L'alcool est dit tertiaire si l'atome de carbone fonctionnel, tétragonal,
est lié à trois atomes de carbone.
Exemples : 3-méthylbutan-1-ol (alcool primaire) et pentan-2-ol
(secondaire).
Le phénol, C6H5-OH, n'est pas un alcool,
car le groupe hydroxyle est lié à un carbone trigonal.
L'oxydation d'un alcool primaire donne un aldéhyde, puis, si
l'oxydant est en excès, un acide carboxylique.
L'oxydation d'un alcool secondaire donne une cétone.
Les alcools tertiaires ne sont pas oxydés, mais leurs molécules
peuvent être brisées par des oxydants.
12.3. Exercices
Page 178 et suivantes, exercices 10 (reconnaissance de groupe fonctionnel
et nomenclature), 11 (Lewis + idem), 12 (idem), 13 (idem et isomères).
Haut
de cette page ? 
13. Cohésion de la matière
13.1. Édifices atomiques
Les atomes s'associent pour donner des cristaux ioniques (NaCl), des cristaux
métalliques (Fe), des molécules. La cohésion de ces
édifices est assurée par l'interaction électromagnétique.
Supposons que nous souhaitions faire passer de l'eau de l'état
solide, à un état (très instable) dans lequel tous
les atomes seraient séparés. Nous devrons fournir de l'énergie
pour séparer les molécules d'eau (passage de l'état
solide à l'état liquide, puis gazeux), puis pour casser les
liaisons chimiques à l'intérieur des molécules <->
E électromagnétique. Plus de l'énergie
nécessaire pour repousser l'air ambiant (passage de l'eau à
l'état gazeux <-> Epp) et pour l'augmentation d'agitation
thermique <-> Ec.
13.2. Cohésion des molécules
Elle est due à l'interaction électromagnétique,
attraction entre électrons et protons.
| L'énergie de la liaison chimique A-B, notée DA-B,
est égale à l'énergie qu'il faut fournir à
une mole de molécules AB pour casser une mole de liaisons A-B. |
Les molécules A-B et les groupes A et B étant à l'état
gazeux.
L'énergie d'une liaison dépend peu de la molécule
considérée. Exemple :
| Composé |
H-CH3 |
H-CH2OH |
H-CCl3 |
| DC-H en kJ.mol-1 |
435 |
390 |
402 |
L'énergie molaire de cohésion d'une molécule est égale
à la somme des énergies des liaisons dans cette molécule.
Quelques énergies de liaison :
| Liaison |
H-H |
H-C |
C-C |
C=C |
H-N |
C-O |
C=O (aldéhydes...) |
C=O
(CO2) |
O-H |
O=O |
| Énergie de liaison en kJ.mol-1 |
436 |
415 |
345 |
615 |
390 |
356 |
743 |
804 |
463 |
498 |
13.3. Les différents états de la matière
Solides et liquides sont des états condensés de la
matière, leur masse volumique est au moins 1000 fois plus grande
que celle des gaz.
Dans un gaz, les molécules sont à une distance très
supérieure au diamètre moléculaire (10 fois environ).
dans les liquides et les solides, les molécules se touchent.
Dans les gaz, les molécules n'interagissent pas (sauf choc).
13.4. Cohésion d'une collection de molécules
| L'énergie de cohésion intermoléculaire est l'énergie
qu'il faut fournir à un assemblage de molécules pour les
disperser. |
Elle est environ 10 fois plus faible que l'énergie intramoléculaire,
énergie molaire de cohésion d'une molécule.
Cela permet de distinguer les transformations chimiques qui concernent
les liaisons intramoléculaires et les transformations physiques
(changements d'état) qui concernent les liaisons intermoléculaires.
| Espèce |
eau H2O |
ammoniaque NH3 |
méthane CH4 |
butane C4H10 |
| Énergie de cohésion en kJ.mol-1 |
41 |
23 |
8 |
22 |
L'énergie cinétique d'agitation thermique d'une mole de molécules
est égale au produit R.T, où R = 8,31 J.mol-1.K-1
est la constante des gaz parfaits, et T est la température en kelvin.
Donc à température égale, les grosses molécules
vont en moyenne moins vite que les petites. Mais dans une collection de
molécules identiques, cette valeur permet d'obtenir la vitesse moyenne.
A un instant donné, certaines molécules vont plus vite, d'autres
moins.
A 20 °C, elle vaut 2,4 kJ.mol-1. A comparer aux valeurs
du tableau précédent. Expliquez pourquoi le méthane
est gazeux à 20 °C.
13.5. Exercices
Page 203 et suivantes, exercices 10 (énergie de liaison),
12 (mole, chaleur latente), 17 (chaleur de réaction)
13.6. Travail pratique
Haut
de cette page ? 
14. Aspects énergétiques et effets
thermiques
14.1. Effets thermiques
Une réaction chimique qui libère de l'énergie
est dite exothermique. Si elle nécessite un apport d'énergie,
elle est dite endothermique.
14.2. Énergie de réaction
On appelle énergie de réaction la variation d'énergie
chimique d'un système au cours d'une réaction.
Si la réaction est exothermique, l'énergie de réaction
est négative. En effet, une telle réaction s'accompagne
d'une augmentation de la température, donc de l'énergie thermique,
au dépend de l'énergie chimique (si le système est
isolé, son énergie totale est invariante).
Naturellement, si la réaction est endothermique, l'énergie
de réaction est positive.
14.3. Exemple, réactions entre gaz
Faisons brûler du méthane dans l'air, selon l'équation
CH4 gaz + 2 O2 gaz -> CO2 gaz + 2 H2O
gaz
4 liaisons C-H sont rompues, ainsi que 2 liaisons O=O. En contrepartie,
4 liaisons O-H et 2 liaisons C=O sont formées.
L'énergie de cette réaction, qui est aussi l'énergie
molaire de combustion du méthane, vaut :
4 DCH + 2 DO=O - 4 DOH - 2 DC=O
= - 804 kJ . mol-1.
Cette transformation est très exothermique.
// Note pour les signes : Normalement, nous devrions écrire
état final moins état initial, mais les énergies de
liaison seraient à changer de signe.
14.4. Applications
| Composé chimique |
méthane |
butane |
octane |
éthanol |
| Énergie de combustion en kJ . mol-1 |
882 |
2860 |
5512 |
1367 |
| Énergie de vaporisation en kJ . mol-1 |
8 |
22 |
42 |
43 |
Les combustions permettent d'élever la température, chauffage,
fusion, cuisson. L'énergie thermique dégagée peut
être transformée, avec un rendement faible, en énergie
mécanique.
Voir un schéma de moteur à explosion.
Ces réactions de combustion s'accompagnent d'effets négatifs,
disparition de réserves fossiles non renouvelables, production de
dioxyde de carbone (effet de serre), production d'autres substances plus
toxiques, oxydes d'azote, ozone, hydrocarbures imbrûlés, dioxyde
de soufre.
14.5. Exercices
Page 205 et suivantes, exercices 24 (biocarburant, tep), 25 (capteur
solaire), 26 (chauffage gaz et solaire comparés).
Haut
de cette page ? 
Fin du cours de chimie de 1° S.
 sa représentation de Lewis
sa représentation de Lewis et
sa formule topologique
et
sa formule topologique .
Dans la formule topologique, chaque sommet d'angle et chaque extrémité
de segment correspond à un atome de carbone, sauf si un autre élément
chimique est représenté. Les atomes d'hydrogène liés
aux atomes de carbone ne sont jamais représentés.
.
Dans la formule topologique, chaque sommet d'angle et chaque extrémité
de segment correspond à un atome de carbone, sauf si un autre élément
chimique est représenté. Les atomes d'hydrogène liés
aux atomes de carbone ne sont jamais représentés.



 ou -CH2-CH(CH3)-
ou -CH2-CH(CH3)-
